
题目列表(包括答案和解析)
19.(5分)
(1)在已知浓度的NaOH的溶液测定某H2SO4溶液的浓度,试参考下图,从下表中选出正确的选项 ( )
|
|
锥形瓶中溶液 |
滴定管中溶液 |
选用指示剂 |
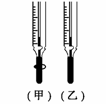 选用滴定管 选用滴定管 |
|
① |
碱 |
酸 |
石蕊 |
(乙) |
|
② |
酸 |
碱 |
酚酞 |
(甲) |
|
③ |
碱 |
酸 |
甲基橙 |
(甲) |
|
④ |
酸 |
碱 |
酚酞 |
(乙) |
A.①② B.①③ C.②③ D.③④
 (2)图Ⅰ表示10mL量筒中液面的位置,A与B,B与C刻度相差1mL,如果刻度A为6,量筒中液体的体积是 ____________mL。
(2)图Ⅰ表示10mL量筒中液面的位置,A与B,B与C刻度相差1mL,如果刻度A为6,量筒中液体的体积是 ____________mL。
(3)图Ⅱ表示50mL滴定管中溶面的位置,如果液面处的读数是a,则滴定管中液体的体积(填代号)___________。
A.是a mL B.是(50-a)mL
C.一定大于a D. 一定大于(50-a)mL
18.在10mL00.1mol·L-1的NaOH的溶液中加入同体积、同浓度的HAC溶液,反应后溶液
中各微粒的浓度关系错误的是 ( )
A.c(Na+)>c(Ac-)>c(H+)>c(OH-) B.c(Na+)>c(Ac-)>c(OH-)<c(CH+)
C.c(Na+)=c(Ac-)+c(HAC) D.c(Na+)+c(H+)=c(Ac-)+c(OH-)
第Ⅱ卷(非选择题,共5分)
17.20℃时,H2S的饱和溶液物质的量浓度为0.1mol·L-1,其电离方程式为:H2S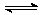 H++HS-,HS-
H++HS-,HS-
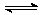 H++S2-,若加要使溶液的pH的增大,同时C(S2-)也增大,可采取的措施是 ( )
H++S2-,若加要使溶液的pH的增大,同时C(S2-)也增大,可采取的措施是 ( )
①加入适量的水 ②加入适量的Na2S的固体 ③加入适量的NaOH固体 ④通入适量SO2气体
A.①②③④ B.①② C.②③ D.③④
16.pH=3的酸溶液和pH=11的碱溶液等体积混合后溶液呈酸性,其原因可能是 ( )
A.生成了一种强酸弱碱盐 B.弱酸溶液和强碱溶液反应
C.强酸溶液和弱碱溶液反应 D.一元强酸溶液和一元强碱溶液反应
15.在Na2HPO4溶液中存在下列平衡:HPO42-+H2O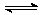 H2PO4-+OH-,,HPO42-
H2PO4-+OH-,,HPO42-  H++PO43-,欲使溶液中c(HPO42-)、c(H+)、c(PO43-)都减小,可采用的方法是
H++PO43-,欲使溶液中c(HPO42-)、c(H+)、c(PO43-)都减小,可采用的方法是
( )
A.加澄清石灰水 B.加盐酸 C.加烧碱 D.加水
14.pH=2的A、B两种酸液各1mL,分别加水稀释到1L(其pH与溶液体积V的关系如图所示),下列说法正确的是 ( )
①a=5时,A是强酸,B是弱酸;②若A、B两种都是弱酸,则5>a>2;③稀释后,A酸溶液的酸性比B溶液强;④A、B两种酸溶液的物质的量浓度一定相等
A.①② B.③④
C.①③ D.②④
13.有人曾建议用AG表示溶液的酸度(acidity grade),AG的定义为AG=lg[C(H+)/C(OH-)].下列表述正确的是 ( )
A.在25℃时,若溶液呈中性,则pH=7,AG=0
B.在25℃时,若溶液呈酸性,则pH<7,AG<0
C.在25℃时,若溶液呈碱性,则Ph>7,AG>0
D.在25℃时,溶液的PH与AG的换算公式为AG=2(7-PH)
12.下列实验实能说明盐酸是比醋酸强的酸的是 ( )
A.将pH=4的盐酸和醋酸稀释到pH=5的溶液,醋酸所加的水量多
B.盐酸和醋酸都可用相应的钠盐与浓H2SO4反应制取
C.相同的pH的盐酸和醋酸溶液中分别加入相应的钠盐固体,醋酸的pH变化大
D.相同的pH的盐酸和醋酸分别跟锌反应,产生H2的起始速度相等
11.在相同的温度时100mL 0.01 mol/L的醋溶液与10mL 0.1 mol/L的醋酸溶液相比较,下列数值前者大于后者的是 ( )
A.中和时所需的NaOH的量 B.电离程度
C.H+的物质量 D.CH3COOH的物质和量
10.下列各组离子,在强碱性溶液中可以大量共存的是 ( )
A.SO23-、NO-3、SO24-、HCO-3 B.I- 、AlO-2 、Cl-、S2-
C.Br-、S2-、Cl-、CO23- D.Na+、K+、NH4+、Ba2+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com