
题目列表(包括答案和解析)
3.可逆反应:CO(气)+NO2(气)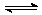 CO2(气)+NO(气);△H=-226
kJ/mol,在下列情况下不能使反应速度加快的是
( )
CO2(气)+NO(气);△H=-226
kJ/mol,在下列情况下不能使反应速度加快的是
( )
A.充入NO2 B.升高温度
C.减小压强,扩大容积体积 D.增加压强,缩小容器体积
2.已知工业上真空炼铷的原理如下:2RbCl+Mg MgCl2+2Rb(g),对于此反应的进行能给予正确解释是 ( )
A.铷的金属活动性不如镁强,故镁可置换铷
B.铷的沸点比镁低,把铷蒸气抽出时,平衡右移
C. MgCl2的热稳定性不如Rb强
D.铷的单质状态较化合态更稳定
1.将等物质的量与X2和Y2置于一密闭容器中,在一定条件下发生反应:
m X2(g)+n Y2(g) 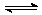 pZ(g),达到平衡时,测得容器中,c(X2)=0.1 mol·L-1,m(Y2)=0.9 mol·L-1, c(Z)=0.8 mol·L-1,则Z的化学式可能是
( )
pZ(g),达到平衡时,测得容器中,c(X2)=0.1 mol·L-1,m(Y2)=0.9 mol·L-1, c(Z)=0.8 mol·L-1,则Z的化学式可能是
( )
 A.X3y
B.XY3
C.X2Y4 D.X3Y3
A.X3y
B.XY3
C.X2Y4 D.X3Y3
26.(8分)工业制备氯化铜时,将浓盐酸用蒸气加热至80℃左右;慢慢加入粗CuO粉末(含杂质Fe203、FeO),充分搅拌,使之溶解,得一强酸性的混合溶液,现欲从该混合溶液中制备纯净的CuCl2溶液,采用以下步骤[参考数据:pH≥9.6时,Fe2+完全水解成Fe(OH)2;pH≥6.4时,Cu2+完全水解成Cu(OH)2;pH≥3.7时,Fe3+完全水解成Fe(OH)3.]请回答以下问题
(1)第一步除去Fe2+,能否直接调整pH=9.6将Fe2+沉淀除去?__________,理由是____________________________,有人用强氧化剂NaClO将Fe2+氧化为Fe3+:
①加人NaClO后,溶液的pH变化是 (填代号)
A.一定增大 B.一定减小 C.可能增大 D.可能减小
②你认为用NaClO作氧化剂是否妥当?__________,理由是___________现有下列几种常用的氧化剂,可用于除去混合溶液中Fe2+的有___________(有几个选几个填代号)
A.浓HNO3 B.KMn04 C.Cl2 D.O2 E.H2O2
(2)除去溶液中的Fe3+的方法是调整溶液的pH=3.7,现有下列试剂均可以使强酸性溶液的pH调整到3.7,可选用的有 (多选不限,填代号)
A.NaOH B.氨水 C.Cu(OH)2C03
D.Na2C03 E.CuO F.Cu(OH)2
25.(7分)用中和滴定法测定烧碱的纯度,若烧碱中不含有与酸反应的杂质,试根据实验回答:
(1)准确称取4.1g烧碱样品,所用主要仪器是________________.
(2)将样品配成250mL待测液,需要的仪器有__________________.
(3)取10.00ml待测液,用_________________量取.
(4)用0.2010mol·L-1标准盐酸滴定待测烧碱溶液,滴定时_________手旋转_______
式滴定管的玻璃活塞,__________手不停地摇动锥形瓶,两眼注视________,直到滴定终点。
(5)根据下表数据,计算待测烧碱溶液的浓度:____________.
|
滴定次数 |
待测液体积(mL) |
标准盐酸体积(mL) |
|
|
滴定前读数(mL) |
滴定后读数(mL) |
||
|
第一次 |
10.00 |
0.50 |
20.40 |
|
第二次 |
10.0 |
4.00 |
24.10 |
(6)根据上述各数据,计算烧碱的纯度:_________________.
24.(7分)用实验确定某酸HA是弱电解质。两同学的方案是:
甲:①称取一定量的HA配制0.1mol/L的溶液100mL;②用pH试纸测出该溶液的pH值,即可证明HA的弱电解质.
乙:①用已知物质的量浓度的HA溶液、盐酸,分别配制pH=1的两种酸溶液各100mL;②分别取这两种溶液各10mL,加水稀释为100mL;③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质.
(1)在两个方案的第①步中,都要用到的定量仪器是_________________________.
(2)甲方案中,说明HA是弱电解质的理由是测得溶液的pH___________1(选填“>”、“<”、“=”).
乙方案中,说明HA是弱电解质的现象是_________(多选扣分).
(a)装HCl的试管中放出H2的速度快;
(b)装HA溶液的试管中放出H2的速度快;
(c)两个试管中产生气体速率一样快.
(3)请你评价乙方案中难以实现之处和不妥之处:________________________________
___________________________________________.
(4)请你再提出一个合理而比较易进行的方案(药品可任取),作简明扼要表述.
答:____________________________________________________________________
________________________________________________________________________.
23.(6分)某二元弱酸(简称为H2A)按下列发生一级和二级电离;H2A 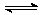 H++HA-,HA-
H++HA-,HA-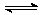 H++A2-
H++A2-
已知相同浓度时的电防度а(H2A)> а(HA-),设有下列四种溶液:
A.0.01 mol·L-1的H2A溶液
B.0.01 mol·L-1的NaHA溶液
C.0.02 mol·L-1的HCl与0.04 mol·L-1的NaHA的溶液等体积混合溶液
D.0.02 mol·L-1的NaOH与0.02 mol·L-1的NaHA的溶液等体积混合溶液
据此,填写下列空白(填代号):
(1)C(H+)最大的是_______________________,最小的是______________________
(2)C(H2A)最大的是_______________________,最小的是______________________
(3)C(A2-)最大的是_______________________,最小的是______________________
22.(6分)已知氨水的电离程度与醋酸的电脑程度在同温同浓度下相等,溶有一定量氨的氯化铵溶液呈碱性。现向少量的Mg(OH)2悬浊液中,加入适量的饱和氯化铵溶液,固体完全溶解。甲同学的解释是:
Mg(OH)2(固)
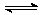 Mg2++2OH-……………………………………………①
Mg2++2OH-……………………………………………①
NH+4+H2O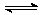 NH3·H2O+H+………………………………………………②
NH3·H2O+H+………………………………………………②
H++OH-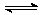 H2O ………………………………………………………③
H2O ………………………………………………………③
由于NH+4水解显酸性,H+与OH-反应生成水,导致反应①平衡右移,沉淀溶解,乙同学的解释是:
Mg(OH)2(固)
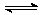 Mg2++ 2OH-…………………………………………①
Mg2++ 2OH-…………………………………………①
NH+4+OH-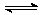 NH3·H2O…………………………………………………②
NH3·H2O…………………………………………………②
由于NH4Cl电离出的NH+4与Mg(OH)2电离出的OH-结合,生成了弱的电解质NH3·H2O,导致反应①的平衡右移,Mg(OH)2的沉淀溶解。
(1)丙同学不能肯定哪位同学的解释合理,于是选用下列的一种试剂,来证明甲、乙两位同学的解释只有一种正确,他选用的试剂是_________(填写编号)
A.NH4NO3 B.CH3COONH4 C. Na2CO3 D.NH3·H2O
(2)请你说明丙同学作出该选择的理由 ___________
_____________________________________________________________________。
(3)丙同学将所选试剂滴入Mg(OH)2的浊液中,Mg(OH)2溶解;由此推知,甲和乙哪位同学的解释更合理__________(填“甲”或“乙”);完成NH4Cl饱和溶液使Mg(OH)2悬浊液溶解的离子方程式____________________________________。
21.(6分)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
①c(Cl-)>c(NH4+)>c(H+)>c(OH-) ②c(Cl-)>c(NH4+)>c(OH-)>c(H+)
③c(NH4+)c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(NH4+)>c(OH-)
填写下列空白:
(1)若溶液中只溶解了一种溶质,则该溶质是________,上述四种离子浓度的大小顺序
_______(填序号)。
(2)若上述关系中③是正确的,则溶液中的溶质为 ______________________;若上述关系中④是正确的,则溶液中的溶质为_____________________。
(4) 若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)___________c(NH3·H2O)(填“大于”、“小于”或“等于”,下同),混合前酸中c(H+)和碱中c(OH-)的关系c(H+)_____________c(OH-)。
20.(6分)准确移取25.00mL的某未知浓度的盐酸溶液于一洁净锥形瓶中,然后用0.20mol·L-1NaOH溶液滴定(指示剂为酚酞)。滴定结果如下:
|
|
NaOH溶液起始读数 |
NaOH溶液终点读数 |
|
第一次 |
0.01mL |
18.60mL |
|
第二次 |
0.20mL |
18.00mL |
(1) 根据以上数据可计算出盐酸的物质量的浓度为_________mol·L-1。(精确到0.01)
(2) 如标准NaOH溶液由于保存不妥而变质(和空气中CO2反应产生少量Na2CO3),测出的盐酸浓度________(填“偏高”、“偏低”、“不变”)
(3) 若操作有误,则导致待测盐溶液浓度偏低的错误操作是__________(填序号)
A.滴定管用蒸馏水洗后未用标准碱液润洗,直接装入标准碱液
B.滴定前滴定管尖端有气泡,滴定后气泡消失
C.滴定管读数时,滴定前仰视滴定后俯视
D.待测液中指示剂酚酞(为有机弱酸)加得太多
(4)如果准确移取25.00mL 0.20 mol·L-1NNaOH溶液于锥形瓶中,滴入酚酞指示剂,然后用未知浓度的盐酸(装在酸式滴定管中)滴定,是否也可测定出盐酸的物质的量浓度?___________(填“是”或“否”)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com