
题目列表(包括答案和解析)
23.(6分)如图所示,某刚性容器内有一活塞和弹簧,B内为真空,A内已充入3 mol H2和1 mol N2,发生可逆反应:3H2(g)十N2(g)  2NH3(g)(正反应为放热反应),乎衡时,活塞保持静止。此时,
2NH3(g)(正反应为放热反应),乎衡时,活塞保持静止。此时,
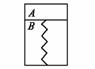 (1)往A内迅速再充人3 mol H2和I mol N2活塞将如何运动?_______________________________;当活塞再次保持静止时,H2的反应速率v与原平衡时H2的反应速率v0的大小关系为v_____v0 (填“<”、“>”或 “二”),同时H2的转化率比原平衡时______(填“增大”、“减小”或“不变”。
(1)往A内迅速再充人3 mol H2和I mol N2活塞将如何运动?_______________________________;当活塞再次保持静止时,H2的反应速率v与原平衡时H2的反应速率v0的大小关系为v_____v0 (填“<”、“>”或 “二”),同时H2的转化率比原平衡时______(填“增大”、“减小”或“不变”。
(2)如果对容器加热,使A内气体温度升高,活塞将向下移动,活塞下滑的原因是
①__________________________________________________________________
②__________________________________________________________________
22.(6分) (1)将1 mol CO和1 mol H2O(g)充入某固定容积的反应器,在某条件下达到平衡:
CO(g)+H2O(g)中CO2(g)十H2(g),此时有2/3的CO转化为CO2。
①该平衡混合物中C02的体积分数为______。
②若在相同条件下,向容器中充入1 mol CO2、1 mol H2和1 mol H2O,则达到平衡时与(1)相比较,平衡应向______移动(填“正反应方向”、“逆反应方向”或“不”),此时平衡混合物中CO2的体积分数可能是下列各值中的_____(填编号)
A.22.2% B.27.55% C.33.3% D.36.8%
③假如②中平衡向正反应方向移动时,则下列说法中正确的是_____(填序号)
①生成物的产量一定增加 ②生成物的体积分数一定增加
③反应物的转化率一定增加 ④反应物的浓度一定降低
⑤正反应速率一定大于逆反应速率 ⑥一定使用了催化剂
 (2)已知在硫酸工业中
(2)已知在硫酸工业中
①SO2转化为SO3的反应为2SO2+O2 2SO3(正反应放热)
②经测定,在常压下上述反应的平衡混合气体中,SO3的体积
分数为91%。
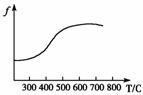
③催化剂V2O5的催化效率/与温度T有如图关系。
④经除尘去杂后的SO2气体的温度约为200℃,反应后的SO3,气体的温度约为600℃。
请根据以上信息,选择SO2氧化为SO2的适宜生产条件是______________
__________。
21.(6分)在重铬酸钾(K2Cr2O7)溶液中存在如下平衡:
Cr2O2-7+H20 2HCrO-7
2HCrO-7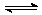 Cr2O2-4+2H+
Cr2O2-4+2H+
(1)加入H2SO4,使Cr2O72-溶液的pH降低,则溶液中c(Cr2O72-)与c(Cr2O42-)的比值
将______(填“增大”、“减小”或“不变”)。
(2)向K2Cr2O7溶液中加入AgNO3溶液,发生离子互换反应,生成砖红色沉淀且溶液的pH下降,生成的砖红色沉淀的化学式为 __。
(3)重铬酸钾在酸性溶液中是强氧化剂。例如它在H2SO4存在的条件下要把Fe2+离子
氧化成Fe3+离子,本身被还原成Cr3+离子。该反应的离子方程式为_______。
20.(6分)在直空密闭容器内加入a mol PH4I固体,在一定温度下发生如下反应:
PH4I(s) 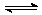 PH3(g)+HI(g) 4 PH3(g)
PH3(g)+HI(g) 4 PH3(g) 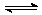 P4(g)+6H2(g)
P4(g)+6H2(g)
2HI(g) 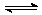 H2(g)+ I2(g)以上三反应建立平衡后,测得HI为b mol、I2(g)为c mol、H2为 d mol。求:
H2(g)+ I2(g)以上三反应建立平衡后,测得HI为b mol、I2(g)为c mol、H2为 d mol。求:
(1)平衡后,容器内P4(g)和PH3的物质的量(用代数式表示)
n(P4)=__________; n(PH3)=__________;
(2)a、b、c三者的关系服从a>_____ (填含b、c的代数式)。
b、c、d、三者的关系服从b>_____(填c、d的代数式)。
(3)平衡后,增大压强,容器内n(I2)____ , n(PH4I)_____ (填“增加”、“减小”或“不变”)。
19.(7分)将1 mol I2(g)+ 2 mol H2(g) 2HI(g);△H<0,并达到平衡。HI的体分数为φ(HI)随时间的变化如右图中曲线(Ⅱ)所示:
2HI(g);△H<0,并达到平衡。HI的体分数为φ(HI)随时间的变化如右图中曲线(Ⅱ)所示:
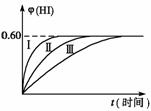 (1)达到平衡时,I2(g)的物质的量浓度为_____ mol·L-1。
(1)达到平衡时,I2(g)的物质的量浓度为_____ mol·L-1。
(2)若改变反应条件,在甲条件φ(HI)的变化如图中曲线(Ⅰ)所示,在乙条件下φ(HI)的变化如图中曲线(Ⅲ)所示,则甲条件可能是______ ,乙条件可能是______ (填入下列条件的序号)。
①恒容条件下,升高温度 ②恒容条件下,降低温度 ③恒温条件下,缩 小反应容器的体积 ④恒温条件下,扩大反应容器的体积 ⑤恒温、恒容的条件下,加入适当催化剂
(3)若保持温变不变,在另一容积也为2 L的密闭容器中加入a molI2(g)、b molH2、 和c mol HI(a、b、c均大于0),发生反应达到平衡时,HI的体积分数仍为0.60,则a、b、c的关系是________。
18.在固定容积的密闭容器中,反应2X Y(g)+Z(s)已达到平衡,此时升高温度则气体混合物的密度增大,下列叙述正确的是
( )
Y(g)+Z(s)已达到平衡,此时升高温度则气体混合物的密度增大,下列叙述正确的是
( )
A.若X为非气态,则正反应为放热反应
B.若正反应为放热反应,则X为气态
C.在平衡混合物中加入少量Z(s),则平衡向左移动
D.压强变化对该平衡没有影响
第Ⅱ卷(选择题,共49分)
17.一定温度下,在带活塞的密闭容器中,反应H2(g)+I2(g)  2HI(g)(正反应为放热反应)达到平衡后,下列说法中不正确的是
( )
2HI(g)(正反应为放热反应)达到平衡后,下列说法中不正确的是
( )
A.恒压时,通入HI气体,刚开始时正反应速率会减小
B.恒温时,减小容积,平衡不移动,但气体颜色加深
C.恒容时,通入H2,I2的质量分数减小
D.恒容时,升高温度,平衡向逆反应方向移动,正反应速率减小
16.在1只固定容积的密闭容器中,放入3 L气体X和2L气体Y,在一定条件下发生了下列反应:4X(g)+3Y(g) 2Q(g)+nR(g)在平衡后,容器内温度不变,混合气体的压强比原来增大了50%,X的浓度减小1/3,则此反应中的n值是
( )
2Q(g)+nR(g)在平衡后,容器内温度不变,混合气体的压强比原来增大了50%,X的浓度减小1/3,则此反应中的n值是
( )
A.3 B.4 C.5 D.6
15.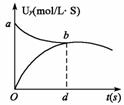 在密闭容器中充入X、Y两种物质各2 mol,发生如下反应:当反应达到平衡后,以Y的浓度改为表示反应速率V正,V逆与时间t的关系如图。如果容器的容积固定为2 L,则Y的平衡浓度的表在式(式中的S指对应区域的面积)为
( )
在密闭容器中充入X、Y两种物质各2 mol,发生如下反应:当反应达到平衡后,以Y的浓度改为表示反应速率V正,V逆与时间t的关系如图。如果容器的容积固定为2 L,则Y的平衡浓度的表在式(式中的S指对应区域的面积)为
( )
A.2-Saob
B.1-Saob
C.2-Sabd
D.1-Sbod
14.对反应4NH3(g)+3O2(g) 2N2(g)+6H2O(g);△H<0。下列有关叙述正确的是
( )
2N2(g)+6H2O(g);△H<0。下列有关叙述正确的是
( )
A.化学反应速率关系是2V(NH3)=3V(H2O)
B.若单位时间内生成a mol NO,同时消耗a mol NH3
C.其他条件不主,增大容积体积,则正反应速率减小,逆反应速率增大
D.其他条件不变,降低温度,NO的物质的量分数将增大
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com