
题目列表(包括答案和解析)
5.把0.3g下列金属分别放入100mL.0.1mol/L的盐酸中,产生H2量最多的是
A.钠 B.镁 C.铝 D.锌
4.下列反应中,Na2O2只表现强氧化性的是
A.2Na2O2+2H2O=4NaOH+O2↑ B.Na2O2+MnO2=Na2MnO4 C.2Na2O2+H2SO4=2Na2SO4+2H2O+O2↑ D.5Na2O2+2KMnO4+8H2SO4=5Na2SO4+K2SO4+2MnSO4+5O2↑+8H2O
3.下列物质中,既可与盐酸反应,又可与氢氧化钠溶液反应的是
A.NaHSO4 B.NaHCO3 C.Na2SO3 D.NH4NO3
2.金属钠长期置于空气中,最终变成
A.Na2O2 B.Na2O C.Na2CO3 D.Na2CO3·10H2O
1.在氢气还原氧化铜的实验中
A.氧化铜发生还原反应 B.氢气发生还原反应
C.铜发生还原反应 D.水发生还原反应
23.用含杂质30%的硫铁矿2.0 t来生产硫酸。已知煅烧时有1.5%的硫受损失而混入炉渣,SO2接触氧化的转化率为95%,计算可生成98%的硫酸多少吨?(杂质不含硫元素。)
24
|
MnO2+4HCl ===== MnCl2+Cl2↑+2H2O 计算:
(1)反应生成的氯气在标况下的体积。
(2)参加反应的HCl中被氧化的HCl的质量。
|
20.(6分) ___沸腾炉___、 接触室 、 吸收塔 。 吸收塔 。_ 二氧化硫(SO2) ,_酸雨 。 |
22.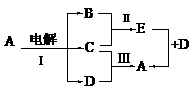 如图所示,E为黑色物质,B为空气的主要成分之一,C是红色金属,反应Ⅲ是C在D的稀溶液中进行,则:
如图所示,E为黑色物质,B为空气的主要成分之一,C是红色金属,反应Ⅲ是C在D的稀溶液中进行,则:
⑴ A是_______________,C是________________, D是_________________;
⑵ 写出反应Ⅰ的离子方程式:
_________________________________________________________
⑶ 在上图中,有两种方法可以制取A,由反应Ⅲ制取A记为方法①,由E+D反应制取A记为方法②。你认为其中__________法更好,理由是:______________________。
21.(5分) ⑴ 已知CuSO4溶液分别与Na2CO3溶液、Na2S溶液的反应情况如下:
① CuSO4+Na2CO3: 主要:Cu2++2OH- ==== Cu(OH)2↓
次要:Cu2++CO32- ==== CuCO3↓
② CuSO4+Na2S: 主要:Cu2++S2― ==== CuS↓
次要:Cu2++OH― ==== Cu(OH)2↓
则Cu(OH)2、CuS、CuCO3的溶解度由大到小顺序是_____________________
⑵ 在反应:11P+15CuSO4+24H2O ==== 5Cu3P+6H3PO4+15H2SO4 中5mol CuSO4可氧化P的物质的量为__________mol。
20.(6分) 接触法制硫酸的主要设备是:____________、______________、____________。
在______进行的反应中硫元素的化合价没有变化。硫酸工业尾气中造成大气污染的是________,大气中该气体带来主要危害是_____________。
19.(9分)(1)在下面的化学方程式中,标出电子转移方向和数目,并指出氧化剂和还原剂,氧化产物和还原产物:
3Cu+8HNO3 ==== 3Cu(NO3)2+2NO↑+4H2O
氧化剂 还原剂 氧化产物 还原产物
(2)配平方程式:
____ HNO3+____ H2S -- ____ NO2↑+_____ H2SO4+____ H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com