
题目列表(包括答案和解析)
18.只用氯化钡溶液及试管鉴别Na2SO3溶液和稀硫酸,简述实验步骤及结论。
17.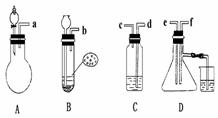 已知实验室制取H2S气体的原理是:FeS+H2SO? FeSO4+H2S.根据 下图中A-D的实验装置和试剂进行实验,回答下列问题:
已知实验室制取H2S气体的原理是:FeS+H2SO? FeSO4+H2S.根据 下图中A-D的实验装置和试剂进行实验,回答下列问题:
(1)装置A是由双孔塞、玻璃导管及 和 组装起来的.
(2)组装一套制取SO2气体的装置,并证明SO2既有氧化性,又有还原性.
①按实验装置连接顺序,把a f各导管口连接起来,正确的顺序是 ,连 , 连 ;②C装置中的溶液是 ,反应后该溶液变为无色,说明SO2具有 性;
f各导管口连接起来,正确的顺序是 ,连 , 连 ;②C装置中的溶液是 ,反应后该溶液变为无色,说明SO2具有 性;
③D中产生的现象是 ,说明SO2具有 性;
(3)A装置中发生反应的化学方程式为 .
(4)烧杯中NaOH溶液的作用 .
16.将下列离子Cu2+、Na+、K+、NO3-、OH-、NH4+、H+、SO32-、S2-、SO42-,按可能大量共于溶液中的情况,把它们分成A、B两组,而且每组中都不少于两种阳离子和两种阴离子。试判断A组__________________________;B组______________________。
15.某无色溶液可能会有下列钠盐中的几种:(A)氯化钠,(B)硫化钠,(C)亚硫酸钠,(D)硫酸钠,(E)碳酸钠。向此溶液中加入适量稀H2SO4,有浅黄色沉淀析出,同时有气体产生。此气体有臭鸡蛋气味,可使澄清石灰水变浑浊,不能使品红溶液褪色。根据上述实验回答下列问题:
(1)不能使品红溶液褪色,说明气体中不含________气体;
(2)溶液中存在的钠盐是_________、________、___________;而且______与_______的物质的量之比要大于2:1。
14.将x摩尔H2S和1摩尔O2置于一个容积可变的容器内进行反应,维持容器内气体的压强不变(101千帕),在常温下测得反应前后容器内气体密度分别为d1和d2,若x的取值不同,则H2S的氧化产物可能有以下三种情况(忽略气体的溶解):
(1)全部是SO2,此时的x的取值范围是 ,且d1 d2(填大于、等于、小于)
(2)全部是S,此时x的取值范围是
(3)部分是S,部分是SO2,此时x的取值范围是 ,容器内气体的物质的量为
摩(用含x的关系式表示).
13.下图为固体物质A及其产物发生的一系列反应的框图,每一个方框内表示有一种反应物或生成物(反应条件及反应所需和生成的水均已略去),其中A、G为反应物,C、F在常温下均为气体:
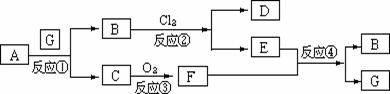
(1)试写出B和C的分子式: 。
(2)写出把F通入到E物质的水溶液中所发生的反应④的离子方程式:
________________________________________________________________.
11.硫酸是极其重要的化工原料,在工业、农业、医药、军事等领域应用广泛。工业上通常用接触法制硫酸,主要原料是硫铁矿和空气。接触法制硫酸的生产过程大致可分为三个阶段:二氧化硫的制取和净化;二氧化硫转化为三氧化硫;三氧化硫的吸收和硫酸的生成。
问题1:设空气中N2、O2的含量分别为0.80和0.20(体积分数),则110 L空气和足量的FeS2完全反应后,气体体积(同温同压)变为___________L。(已知:4FeS2
+ 11O2 2Fe2O3 + 8SO2)
2Fe2O3 + 8SO2)
问题2:为了防止环境污染并对尾气进行综合利用,硫酸厂常用氨水吸收尾气的SO2、SO3等气体,再向吸收液中加入浓硫酸,以制取高浓度的SO2及(NH4)2SO4和NH4HSO4固体。
为了测定测定上述(NH4)2SO4和NH4HSO4固体混合物的组成,现称取该样品四份,分别加入相同浓度的NaOH溶液50.00 mL,加热至120℃左右,使氨气全部逸出[(NH4)2SO4和NH4HSO4的分解温度均高于200℃],测得有关实验数据如下(标准状况):
|
实验序号 |
样品的质量/g |
NaOH溶液的体积/mL |
氨气的体积/L |
|
1 |
3.62 |
50.00 |
0.896 |
|
2 |
7.24 |
50.00 |
1.792 |
|
3 |
10.86 |
50.00 |
2.016 |
|
4 |
14.48 |
50.00 |
1.568 |
⑴由1组数据直接推测:1. 81 g样品进行同样实验时,生成氨气的体积(标准状况)为__________L。
⑵试计算该混合物中(NH4)2SO4和NH4HSO4的物质的量之比为___________。
⑶求所用NaOH溶液的物质的量浓度。(写出计算过程)
12测定水中溶解氧气的方法是:取a mL水样,迅速加入MnSO4溶液及含有NaOH的KI溶液,立即塞好塞子、振荡,使反应充分;开塞,迅速加入适量H2SO4,此时有I2生成;用Na2S2O3溶液(浓度b mol·L-1)和I2反应,消耗了V mL达到终点(以淀粉作指示剂)。有关方程式为:
①2Mn2++O2+4OH-===2MnO(OH)2(反应很快)②MnO(OH)2+2I-+4H+===Mn2++I2+3H2O
③I2+2S2O32-===S4O62-+2I-
(1)需要进行滴定的反应是________________,终点的颜色变化为__________________。
(2)水中溶解O2为(以mg/L为单位)_____________________。
(3)加MnSO4及含NaOH的KI溶液振荡时,塞子若未塞紧(设未溅出溶液),测得结果将___________(填“偏高”“偏低”或“无影响”),原因是_____________________。
10.将一定量混合均匀的铁粉与硫粉在隔绝空气的条件下共热,充分反应后冷却至室温,得到固体A。将质量为m的固体A加入到300mL 2mol·L-1盐酸中使之完全溶解。测得室温下加入固体A的质量与收集到气体体积(已换算成标准状况)的关系如右图所示(假设所得氢硫酸溶液饱和前无硫化氢气体逸出)。
已知加入固体A的质量m≤3.2g时,收集到的气体为氢气;当m>3.2g时,收集到的气体来H2和H2S的混合气。试分析与计算:
(1)3.2g固体A中各物质的物质的量分别为 ,溶于上述盐酸充分反应后,所得溶液中氢硫酸的物质的量浓度为(忽略溶液体积的变化)
;
(2)当固体A全部溶于上述盐酸,且A的质量m>3.2时,收集到的气体体积(标准状况下)V= mL(用含m的代数式表示)。
9.将1.95g由Na2SO4和Na2CO3组成的混合物溶于水得溶液A,在A中加入10mL未知浓度的BaCl2溶液恰好完全反应,过滤得沉淀B,向B中加入足量稀硫酸,沉淀不消失反而增加0.18g。计算:
(1)原混合物中Na2CO3的质量分数。 (2)BaCl2溶液的物质的量浓度。
8.实验室中根据2SO2+O2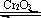 2SO3+196.6kJ设计如下图所示实验装置来制备SO3固体。请回答下列问题。
2SO3+196.6kJ设计如下图所示实验装置来制备SO3固体。请回答下列问题。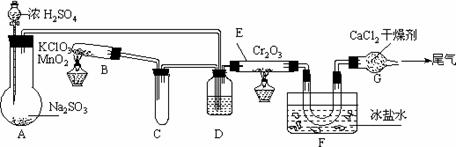
⑴实验前,必须进行的操作是(填操作名称,不必写具体过程)
⑵在A装置中加入Na2SO3固体的同时,还需加几滴水,然后再滴加浓硫酸。加几滴水的作用是
⑶小试管C的作用是
⑷广口瓶D内盛的试剂是 。装置D的三个作用是
①
②
③
⑸实验中当Cr2O3表面红热时,应将酒精灯移开一会儿再加热,以防温度过高,这样做的原因是
⑹装置F中U型管内收集到的物质的颜色、状态是
⑺装置G的作用是
⑻从G装置导出的尾气处理方法是
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com