
题目列表(包括答案和解析)
10、随着反应地进行,浓盐酸的逐渐减小,而稀盐酸与MnO2共热不能制得Cl2。
9、由于KI过量, HNO3能将I-氧化成I2,I2溶于KI溶液呈现深黄色;2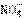 +8H++6I-=2NO+3I2+4H2O,I2+I-=
+8H++6I-=2NO+3I2+4H2O,I2+I-=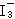 。
。
8、加液氨后, 使HClO部分转化为较稳定的NH2Cl,当HClO开始消耗后,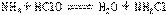 这个化学平衡向左移动,又产生HClO起杀菌作用。故能延长液氯杀菌的时间。
这个化学平衡向左移动,又产生HClO起杀菌作用。故能延长液氯杀菌的时间。
7、在自来水中通入Cl2时,Cl2和H2O反应:Cl2+H2O=HCl+HClO,HClO具有强氧化性,可以消毒杀菌,再加入绿矾处理, Fe2+能除去水中的余氯,Cl2+Fe2+=2Cl-+2Fe3+, 同时Fe2+的氧化产物Fe3+能发生水解反应,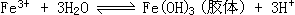 。
。
Fe(OH)3胶体具有较强的吸附能力,吸附水中的泥土胶体和悬浮物而沉降,使水进一步净化,水质得到改善。
6、S、I2、Br2 因为还原性是S2->I->Br-。
5、碘化物、碘酸盐,碘化物在空气中久置,特别是在阳光的作用下会被空气氧化而呈现碘的颜色。
4I-+O2+2H2O=2I2+4OH-。
4、(1)NaCl+AgNO3=AgCl↓+NaNO3。
(2) 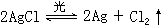
3、干燥的Cl2在常温下与Fe反应,Fe能与I2反应生成FeI2
2、因为漂白粉中含有CaCl2, 容易吸收空气中的水蒸气而潮解引起产品变质。
1、(1) 溶液先后变红后褪色。 因为新制氯水中含有 Cl2、H2O、HClO 三种分子和H+、 Cl-、ClO-、OH-四种离子。氯水的多种成分决定了它具有多重性质。Cl2+H2O=HCl+HClO。
(1)中起作用的是H+、 HClO及ClO-,H+能使石蕊变红,HClO和ClO-将红色物质漂白。
(2)出现白色沉淀。(2)中起作用的是Cl-,会生成AgCl白色沉淀。HCl+AgNO3=AgCl↓+HNO3。
(3)有气泡产生。(3)中起作用的是H+,遇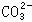 产生气体。2HCl+Na2CO3=2NaCl+H2O+CO2↑
产生气体。2HCl+Na2CO3=2NaCl+H2O+CO2↑
(4)溶液由浅绿色变黄棕色。(4)中起作用的是Cl2的强氧化性。2FeCl2+Cl2=2FeCl3。
(5)有色布条褪色。因为Cl2与H2O反应生成具有漂白作用的HClO。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com