
题目列表(包括答案和解析)
1. 了解有机化合物数目众多和异构现象普遍存在的本质原因。
[例题89]:进行一氯取代反应后,只能生成三种沸点不同的产物的烷烃是
A. (CH3) 2 CH CH2CH2CH3 B, (CH3 CH2) 2 CHCH3
C. (CH3) 2 CH CH (CH3) 2 D. (CH3) 3 C CH2CH3
11、(1)①KHSO4+Ba(NO3)2==BaSO4↓+KNO3+HNO3
②2HNO3+Ba(OH)2==Ba(NO3)2+2H2O;
(2)1:1:1;
(3)不能,因为强热时HNO3会分解;
(4)重结晶
12、(1)Mn(NO3)2,Mn(NO3)2 MnO2+2NO2↑,Hg(NO3)2,产生有汞蒸气污染严重,且凝于盛N2O4液体管中。
(2)无影响,没有水产生,不会引起试管炸裂。
(3)棕黄或微黄,有与NO2的平衡,2NO2
MnO2+2NO2↑,Hg(NO3)2,产生有汞蒸气污染严重,且凝于盛N2O4液体管中。
(2)无影响,没有水产生,不会引起试管炸裂。
(3)棕黄或微黄,有与NO2的平衡,2NO2 N2O4。
(4)有棕色气体,缓冲防止D中碱液倒吸至B。
(5)吸收NO2防止污染
3NO2+2OH- == 2
N2O4。
(4)有棕色气体,缓冲防止D中碱液倒吸至B。
(5)吸收NO2防止污染
3NO2+2OH- == 2 +NO+H2O
NO2+NO+2OH-==H2O+2
+NO+H2O
NO2+NO+2OH-==H2O+2 。
13、(1)将导管口放入水中,双手抱握试管(借手心的热量给试管加热),然后松开试管,若抱握时导管口有气泡冒出,松开时导管内吸入一段水性,则说明气密性良好。
(2)3Cu+8HNO3(稀)== 3Cu(CO3)2+2NO↑+4H2O
2NO+O2
== 2NO2
(3)实验开始即有气泡冒出,且越来越快;试管内气体逐渐由无色变为浅红棕色;溶液逐渐由无色变为浅蓝色;铜片逐渐变小,最后全部溶解。
(4)反应开始时,生成的NO较少,与试管中的O2和H2O反应生成了HNO3:4NO+3O2+2H2O
== 4HNO3 消耗了O2,使试管内气压减小,导致水倒吸入导管。
(5)管内液面上升至一定高度,且试管内气体颜色由红棕色逐渐变为无色。
14、(1)高温下PbO与碳反应先生成的主要产物是CO;
(2)吸收CO气体,防止有毒气体污染大气;
(3)高温、低压;
(4)不行,高温下空气中的O2与C可能产生CO2,另外空气中也有少量的CO2,空气中H2O与C反应也可能产生CO2。
15、(1)⑦①③④⑤⑥;
(2)酒精灯;
(3)d、b;
(4)将③换成②,同时撤走酒精灯;
(5)
。
13、(1)将导管口放入水中,双手抱握试管(借手心的热量给试管加热),然后松开试管,若抱握时导管口有气泡冒出,松开时导管内吸入一段水性,则说明气密性良好。
(2)3Cu+8HNO3(稀)== 3Cu(CO3)2+2NO↑+4H2O
2NO+O2
== 2NO2
(3)实验开始即有气泡冒出,且越来越快;试管内气体逐渐由无色变为浅红棕色;溶液逐渐由无色变为浅蓝色;铜片逐渐变小,最后全部溶解。
(4)反应开始时,生成的NO较少,与试管中的O2和H2O反应生成了HNO3:4NO+3O2+2H2O
== 4HNO3 消耗了O2,使试管内气压减小,导致水倒吸入导管。
(5)管内液面上升至一定高度,且试管内气体颜色由红棕色逐渐变为无色。
14、(1)高温下PbO与碳反应先生成的主要产物是CO;
(2)吸收CO气体,防止有毒气体污染大气;
(3)高温、低压;
(4)不行,高温下空气中的O2与C可能产生CO2,另外空气中也有少量的CO2,空气中H2O与C反应也可能产生CO2。
15、(1)⑦①③④⑤⑥;
(2)酒精灯;
(3)d、b;
(4)将③换成②,同时撤走酒精灯;
(5) ,偏小,将装置⑤中的水换成饱和NaHCO3溶液。
16、(1)用蒸馏水洗涤沉淀2-3次,并将洗液并入溶液。
(2)酚酞,因达到滴定终点时,溶液呈现中性或弱酸性,Mg(OH)2不会溶解
(3)BaCl2%=
,偏小,将装置⑤中的水换成饱和NaHCO3溶液。
16、(1)用蒸馏水洗涤沉淀2-3次,并将洗液并入溶液。
(2)酚酞,因达到滴定终点时,溶液呈现中性或弱酸性,Mg(OH)2不会溶解
(3)BaCl2%= 17、(1)防止烧瓶受热不均而破裂
17、(1)防止烧瓶受热不均而破裂
 (3)生成的AlCl3受热升华,在E处冷凝析出。
(4)未经除去的HCl气体、水蒸气随Cl2一同进入D管,与铝反应生成H2,易发生H2与Cl2混合爆炸及H2O(气)使AlCl3吸收水而水解后爆炸等。
(5)吸收多余的氯气,以免污染空气;起干燥作用,防止空气中水蒸气进入D管,使生成的AlCl3水解:
(6)AlCl3+3H2O
== Al(OH)3+3HCl↑
18、(1)关闭d的活塞,夹紧C-D间的胶管,将F出口导管插入水中,然后用手捂住微热,若F导出口有气泡冒出,松手后水可回流到导管中,证明D不漏气。
(2)3Fe+4H2O==Fe3O4+H2 洗气瓶 饱和NaHCO3溶液浓H2SO4。
(3)避免Br2蒸气腐蚀橡皮塞
(4)将空气赶走并将Br2蒸气带入反应的钢管中
(5)37.4% (6)NaOH溶液。
19、(1)2Fe3++2I-
== 2Fe2++I2;
(2)B;
(3)否,NH4F在水溶液中水解生成HF,HF会腐蚀玻璃;
(4)滴加NH4SCN溶液,若不呈血红色,说明该说法正确。
20、(1)H2O2;将Fe2+氧化成Fe3+。
(2)CaCO3;可将pH值调整到5.6,Fe(OH)3可完全沉淀,Zn(OH)2不会沉淀,且因为溶液中
(3)生成的AlCl3受热升华,在E处冷凝析出。
(4)未经除去的HCl气体、水蒸气随Cl2一同进入D管,与铝反应生成H2,易发生H2与Cl2混合爆炸及H2O(气)使AlCl3吸收水而水解后爆炸等。
(5)吸收多余的氯气,以免污染空气;起干燥作用,防止空气中水蒸气进入D管,使生成的AlCl3水解:
(6)AlCl3+3H2O
== Al(OH)3+3HCl↑
18、(1)关闭d的活塞,夹紧C-D间的胶管,将F出口导管插入水中,然后用手捂住微热,若F导出口有气泡冒出,松手后水可回流到导管中,证明D不漏气。
(2)3Fe+4H2O==Fe3O4+H2 洗气瓶 饱和NaHCO3溶液浓H2SO4。
(3)避免Br2蒸气腐蚀橡皮塞
(4)将空气赶走并将Br2蒸气带入反应的钢管中
(5)37.4% (6)NaOH溶液。
19、(1)2Fe3++2I-
== 2Fe2++I2;
(2)B;
(3)否,NH4F在水溶液中水解生成HF,HF会腐蚀玻璃;
(4)滴加NH4SCN溶液,若不呈血红色,说明该说法正确。
20、(1)H2O2;将Fe2+氧化成Fe3+。
(2)CaCO3;可将pH值调整到5.6,Fe(OH)3可完全沉淀,Zn(OH)2不会沉淀,且因为溶液中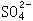 浓度大,使CaSO4变为难溶物质,不会引入杂质Ca2+。
浓度大,使CaSO4变为难溶物质,不会引入杂质Ca2+。
1、(1) 冷凝 吸收未冷凝的气体;
(2)溴蒸气会腐蚀橡皮塞或橡皮管;
(3)当气体被吸收时,液体上升到漏斗中,由于漏斗容积大,导致烧杯中液面明显下降,使漏斗脱离液面,漏斗中的液体又流回烧杯中,防止了倒吸的现象。
2、(1)启普发生器 能。
(2)饱和食盐水 储气瓶。关闭活塞时继续产生的Cl2被迫进入Ⅱ,由于Cl2
在饱和食盐水中的溶解度较小,大部分Cl2充满液面上空间使液体压入漏斗中,保存在瓶Ⅱ的Cl2可以随时开启活塞取用。
3、(1)
冷凝 吸收未冷凝的气体;
(2)溴蒸气会腐蚀橡皮塞或橡皮管;
(3)当气体被吸收时,液体上升到漏斗中,由于漏斗容积大,导致烧杯中液面明显下降,使漏斗脱离液面,漏斗中的液体又流回烧杯中,防止了倒吸的现象。
2、(1)启普发生器 能。
(2)饱和食盐水 储气瓶。关闭活塞时继续产生的Cl2被迫进入Ⅱ,由于Cl2
在饱和食盐水中的溶解度较小,大部分Cl2充满液面上空间使液体压入漏斗中,保存在瓶Ⅱ的Cl2可以随时开启活塞取用。
3、(1)  坩埚。
(2)不能,因为会带入杂质
坩埚。
(2)不能,因为会带入杂质 。
(3)取少量滤液滴入BaCl2溶液,若不再生成沉淀,证明
。
(3)取少量滤液滴入BaCl2溶液,若不再生成沉淀,证明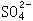 已沉淀完全。
(4)铁架台、铁圈、漏斗、玻璃棒、烧杯。
(5)通足量Cl2,使KI完全转化为KCl;蒸干、灼烧是为了除去水、I2及过量Cl2。
(6)
已沉淀完全。
(4)铁架台、铁圈、漏斗、玻璃棒、烧杯。
(5)通足量Cl2,使KI完全转化为KCl;蒸干、灼烧是为了除去水、I2及过量Cl2。
(6)  4、方案三,理由是:方案一、二不能证明混合气体有SO2,因为若含有乙烯、乙炔等气体,也能使酸性KMnO4溶液或Br2水褪色。方案三能证明混合气中既有SO2,又有CO2,因为混合气体通入品红试液后,品红褪色,通过 DMnO4 溶液使其颜色变浅,证明 CO2 已全部被吸收,再通入石灰水, 出现浑浊证明有CO2。
5、(1)1、6、5、4、3、2
(2)出现白色沉淀 品红不褪色。
(3)取上层清液少许,再加稀H2SO4,若有沉淀生成,说明Ba2+过量,
4、方案三,理由是:方案一、二不能证明混合气体有SO2,因为若含有乙烯、乙炔等气体,也能使酸性KMnO4溶液或Br2水褪色。方案三能证明混合气中既有SO2,又有CO2,因为混合气体通入品红试液后,品红褪色,通过 DMnO4 溶液使其颜色变浅,证明 CO2 已全部被吸收,再通入石灰水, 出现浑浊证明有CO2。
5、(1)1、6、5、4、3、2
(2)出现白色沉淀 品红不褪色。
(3)取上层清液少许,再加稀H2SO4,若有沉淀生成,说明Ba2+过量,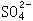 已沉淀完全,
(4)取最后洗液少许滴加AgNO3溶液,若无沉淀说明已洗净,反之则未洗净。
(5)(1-142w2/233w1)×100%
7、乙:SO3+H2O==H2SO4,不形成酸雾,有利于吸收,SO2不被吸收;
丁:SO3冷凝,SO2通过。
8、(1)2H2SO4(浓)+C==CO2↑+SO2+2H2O
(2)④→②→①→③
(3)验证产物气流中有SO2;将SO2全部氧化吸收;确证产物中SO2已被B瓶溶液全部氧化。
(4)无水CuSO4(或变色硅胶);水汽;由于产物气流通过①、③时会带出水气,所以②必须在①、③之前。
(5)澄清石灰水;CO2。
9、(1)甲不能,乙能。
(2)甲方案中反应产生的NH3全部被浓H2SO4吸收,不能发生后续反应。
10、只有方案(3)可以。其理由如下:方案(1)中先加Mg(NO3)2溶液时,由于MgCO3微溶,所以生成的沉淀除含Mg(OH)2外还有MgCO3,不能将OH-和
已沉淀完全,
(4)取最后洗液少许滴加AgNO3溶液,若无沉淀说明已洗净,反之则未洗净。
(5)(1-142w2/233w1)×100%
7、乙:SO3+H2O==H2SO4,不形成酸雾,有利于吸收,SO2不被吸收;
丁:SO3冷凝,SO2通过。
8、(1)2H2SO4(浓)+C==CO2↑+SO2+2H2O
(2)④→②→①→③
(3)验证产物气流中有SO2;将SO2全部氧化吸收;确证产物中SO2已被B瓶溶液全部氧化。
(4)无水CuSO4(或变色硅胶);水汽;由于产物气流通过①、③时会带出水气,所以②必须在①、③之前。
(5)澄清石灰水;CO2。
9、(1)甲不能,乙能。
(2)甲方案中反应产生的NH3全部被浓H2SO4吸收,不能发生后续反应。
10、只有方案(3)可以。其理由如下:方案(1)中先加Mg(NO3)2溶液时,由于MgCO3微溶,所以生成的沉淀除含Mg(OH)2外还有MgCO3,不能将OH-和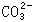 分离;
方案(2)中先加AgNO3试液,Ag+可与Cl-、
分离;
方案(2)中先加AgNO3试液,Ag+可与Cl-、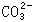 、OH-都反应,使三种离子同时都沉淀而无法一一分离;
方案(3)中先加Ba(NO3)2溶液时,只有
、OH-都反应,使三种离子同时都沉淀而无法一一分离;
方案(3)中先加Ba(NO3)2溶液时,只有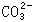 与Ba2+反应生成BaCO3沉淀,过滤后滤液再加入Mg(NO3)2溶液可以使OH-与Mg2+反应生成Mg(OH)2沉淀,再过滤后滤液加入AgNO3溶液,可使Cl-与Ag+反应生成AgCl沉淀,从而使
与Ba2+反应生成BaCO3沉淀,过滤后滤液再加入Mg(NO3)2溶液可以使OH-与Mg2+反应生成Mg(OH)2沉淀,再过滤后滤液加入AgNO3溶液,可使Cl-与Ag+反应生成AgCl沉淀,从而使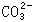 、OH-、Cl-离子一一分离开。
、OH-、Cl-离子一一分离开。
11、钾的酸式盐A和盐B的溶液相互反应,有白色沉淀生成,溶液中生成酸C。加热时酸C能溶解大多数金属,但它不与金、铂反应。加热酸D和盐E可制得酸C。C酸的盐E可用于制造火药。如果D同碱F反应,则可形成酸式盐A。如果C同碱G反应便生成盐B。请回答下列问题。
(1)写出下列化学反应方程式:①A与B的反应;②C与G的反应_____。
(2)D与F反应生成A时,则D、F、A的物质的量之比为_____。
(3)D与E反应制C时,能否加强热?为什么?_____。
(4)把E从E和NaCl组成的混合物中分离出来的最佳方法是_____。
12、实验室制取N2O4需要的NO2可利用无水硝酸盐加热分解获得。现有硝酸盐:Cu(NO3)2、Mn(NO3)2、Hg(NO3)2,若利用热分解以制取NO2,已知它们热分解后的含金属物质分别为CuO、MnO2、Hg,按以下装置制取液态的N2O4:
(1)在A中试管内应装入的上述硝酸盐粉末(使产生的NO2最纯净)应选用(写化学式)的是____,其反应的化学方程式是____________。最不应选用的上述硝酸盐是_____,理由是____________。
(2)A中的试管如果管底向下倾斜而不是管口向下倾斜对操作的影响是_____,其主要理由是_____。
(3)B的烧瓶中得到的N2O4应为_____色,理由是_____,化学方程式是_____。
(4)C装置中的现象是_____,C的作用是_____。
(5)D装置的作用是_____,其中反应的离子方程式是_____。

 13、用右图中的简易装置可以进行气体的发生和收集。
13、用右图中的简易装置可以进行气体的发生和收集。
(1)简述怎样检查装置的所密性?______________。 (2)拔开试管a的橡皮塞,加入10mL 6mol/L稀HNO3和1g铜片,立即将带有 导管的橡皮塞塞紧试管口。反应开始 时速率较慢,逐渐加快。请写在试管 a 中所发生的所有反应的化学方程式 _________________。
(3)从反应开始到反应结束,预期在试管a中可观察到哪些现象?_____。 (4)在反应开始时,可观察到导管b中的水面先沿导管b慢慢上升到一定高度,此后又回落。然后有气泡从管口冒出。试说明反应开始时,导管中水面先上升的原因_____。 (5)试管C收集满气体后,用拇指堵住管口,从水槽中取出。将管口向上,松开拇指,片刻后,再次堵住管口,试管又再次倒置于水槽,松开拇指。此时可观察到什么现象?_____。 14、某学生设计一个实验证明PbO中含有氧,反应方程式如下:



回答下列问题: (1)盛澄清石灰水的试管开始一段时间可能没有现象,其原因是________。 (2)烧杯中醋酸二氨合铜([Cu(NH3)2Ac])的作用是_____。 (3)实验后的醋酸二氨合铜经适当处理又可再生,适宜于再生的生产条件是__________。 (4)若用空气代替干燥氮气,行吗?_____,其理由是___________。 15、根据下图提供的仪器装置,完成提纯并测定 Na2CO3 样品纯度(其中只含NaHCO3杂质)的实验。请回答有关问题:
|
序号 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
|
仪
器
及
装
置 |
 |
 |
 |
 |
 |
 |
 |
实验一:测定Na2CO3样品中NaHCO3分解放出的CO2的体积。
(1)连接装置的正确顺序是(填序号)_____。
(2)完成该实验尚缺的仪器是_____。
(3)产生的气体从装置④的____端进入,从装置⑤的_____端进入。
实验二:测定上述实验完成后的剩余固体与盐酸反应产生的CO2的体积。
(4)应将实验一的装置作哪些调整?_____。
(5)当实验一加热到样品不再产生气体时,产生的CO2为aL(标准状况);实验二在加入盐酸至无气体产生时,生成 CO2 为 bL (标准状况)。 则样品Na2CO3纯度的实测值为_______;与理论值比较,实验结果_______(填:偏大、偏小或相等);若要使实测值更接近于理论值,该实验应怎样改进?_____。
16、BaCl2样品,其中含有少量的Mg2+(约2%,以MgCl2计),为了准确测定纯度,采用盐酸滴定法。具体操作是:
①首先取样品wg配成溶液,
②然后加入V1mL浓度为c1(mol/L)的过量的NaOH溶液,
③充分沉淀后加入指示剂,再用浓度为c2(mol/L)标准盐酸滴定过量的碱,用去盐酸V2mL,试回答:
(1)若滴定前要滤去 Mg(OH)2 沉淀,为保证测定的准确性,过滤时应当注意什么?______________________。
(2)若选用适当的酸碱指示剂,也可不必过滤就滴定,则选用的指示剂是____,不必过滤的原因是_____。
(3)写出计算试样BaCl2纯度的公式:_____。
17、无水氯化铝是白色晶体,易吸收水分,在178 ℃升华。 装有无水氯化铝的试剂瓶久置潮湿空气中,会自动爆炸并产生大量白雾。氯化铝常作为有机合成和石油工业的催化剂,并用于处理润滑油等。工业上由金属铝和氯化作用或由无水氯化氢气体与熔融金属铝作用而制得。某课外兴趣小组在实验室里,通过下列装置制取少量纯净的无水氯化铝。
 (1)开始实验时,不能先点燃A装置的酒精灯,后打开分液漏斗的活塞,将适量浓硫酸注入烧瓶里,其理由是_____;
(2)A装置中发生反应的化学方程式为_____;
(3)在E处装置可收集到纯净AlCl3,其原因是_____;
(4)从A装置导出气体若不经过B、C装置而直接进入D管,将对实验产生不良的后果是_____;
(5)F装置所起的作用有_____;
(6)无水氯化铝在潮湿空气中,会产生大量白雾,有关反应的化学方程式为:______________________
18、实验室用下图装置制取溴化亚铁
(1)开始实验时,不能先点燃A装置的酒精灯,后打开分液漏斗的活塞,将适量浓硫酸注入烧瓶里,其理由是_____;
(2)A装置中发生反应的化学方程式为_____;
(3)在E处装置可收集到纯净AlCl3,其原因是_____;
(4)从A装置导出气体若不经过B、C装置而直接进入D管,将对实验产生不良的后果是_____;
(5)F装置所起的作用有_____;
(6)无水氯化铝在潮湿空气中,会产生大量白雾,有关反应的化学方程式为:______________________
18、实验室用下图装置制取溴化亚铁
 其中A为CO2发生装置,D和d中均盛有液溴,E为外套电阻丝的不锈钢管,e是两只耐高温的瓷皿,其中共盛有56g细铁粉。实验开始时先将铁粉加热至600-700℃,然后将干燥纯净的CO2气流通入D中,E管中反应开始,最后将d中的液溴滴入100-120℃的D中,经过几小时的连续反应,在钢管的一端沉积有黄绿色鳞片状溴化亚铁80g,请回答:
(1)如何检查用塞子(插有导管和分液漏斗)紧塞的D的气密性?
(2)若导入的C炒干燥,会在E中发生副反应,其化学方程式为_____。若在A中盛放固体CaCO3,a中盛6mol/L盐酸,为使导入D中的CO2为干燥纯净的气体,则B、C处装置的名称通常叫_____。(请将B和C的装置的形状画在题中图的空白处)。其中B所盛的试剂应为_____,C所盛的试剂应为_____。
(3)实验时,装置D和E中的橡皮塞最好用铝箔包住,原因是_____。
(4)反应过程中要不断通入CO2,其主要作用是_____。
(5)E中的反应为:
其中A为CO2发生装置,D和d中均盛有液溴,E为外套电阻丝的不锈钢管,e是两只耐高温的瓷皿,其中共盛有56g细铁粉。实验开始时先将铁粉加热至600-700℃,然后将干燥纯净的CO2气流通入D中,E管中反应开始,最后将d中的液溴滴入100-120℃的D中,经过几小时的连续反应,在钢管的一端沉积有黄绿色鳞片状溴化亚铁80g,请回答:
(1)如何检查用塞子(插有导管和分液漏斗)紧塞的D的气密性?
(2)若导入的C炒干燥,会在E中发生副反应,其化学方程式为_____。若在A中盛放固体CaCO3,a中盛6mol/L盐酸,为使导入D中的CO2为干燥纯净的气体,则B、C处装置的名称通常叫_____。(请将B和C的装置的形状画在题中图的空白处)。其中B所盛的试剂应为_____,C所盛的试剂应为_____。
(3)实验时,装置D和E中的橡皮塞最好用铝箔包住,原因是_____。
(4)反应过程中要不断通入CO2,其主要作用是_____。
(5)E中的反应为: ,求此实验中溴化亚铁的产率。
(6)为防止污染空气,实验时应在F处连接盛_____的尾气的吸收装置。
19、甲同学在0.5mol/L的FeCl3溶液中滴加0.1mol/LKI溶液即呈现红棕色,再加入CCl4振荡后静置,可观察到CCl4层呈紫红色,乙同学在0.5mol/L的FeCl3溶液中先加入4mol/LNH4F溶液,发现FeCl3溶液逐渐褪至无色,而后再加入0.1mol/LKI溶液,不呈红棕色,再加CCl4振荡、静置,也观察不到CCl4层有紫红色出现。
(1)甲同学的实验说明 FeCl3 溶液和 KI 溶液发生了什么反应:(用离子方程式表示)_____。
(2)乙同学在实验中观察不到甲同学的实验现象,其原因分析合理的是_____。
(A)Fe3+可被F-还原为Fe2+,使溶液中不再有Fe3+
(B)Fe3+可和F-结合成难电离物质,不再和I-反应
(C)I-和F-或I-和
,求此实验中溴化亚铁的产率。
(6)为防止污染空气,实验时应在F处连接盛_____的尾气的吸收装置。
19、甲同学在0.5mol/L的FeCl3溶液中滴加0.1mol/LKI溶液即呈现红棕色,再加入CCl4振荡后静置,可观察到CCl4层呈紫红色,乙同学在0.5mol/L的FeCl3溶液中先加入4mol/LNH4F溶液,发现FeCl3溶液逐渐褪至无色,而后再加入0.1mol/LKI溶液,不呈红棕色,再加CCl4振荡、静置,也观察不到CCl4层有紫红色出现。
(1)甲同学的实验说明 FeCl3 溶液和 KI 溶液发生了什么反应:(用离子方程式表示)_____。
(2)乙同学在实验中观察不到甲同学的实验现象,其原因分析合理的是_____。
(A)Fe3+可被F-还原为Fe2+,使溶液中不再有Fe3+
(B)Fe3+可和F-结合成难电离物质,不再和I-反应
(C)I-和F-或I-和 结合成难电离物质,不再和Fe3+反应
(3)乙同学所用的NH4F溶液是用塑料瓶装的,可否改用玻璃试剂瓶?____(填可或否),为什么?_______________。
(4)在FeCl3溶液中,加入适量NH4F溶液后,溶液中Fe3+浓度几乎为零,用什么方法可以检验这种说法的正确性?_____。
20、某小化工厂生产皓矾(ZnSO4·7H2O),结晶前的饱和溶液(酸性)中含有少量Cu2+、Fe3+、Fe2+等杂质。已知:0.01mol/L的Fe3+开始沉淀为Fe(OH)3到完全沉淀的pH值范围为2.7-3.7;饱和ZnSO4溶液(0.34mol/L)开始沉淀为Zn(OH)2到完全沉淀的pH值范围为5.7-8;当pH<5.6时,Na2CO3、CaCO3发生酸解生成CO2。该厂除杂质的工艺流程如下所示:
结合成难电离物质,不再和Fe3+反应
(3)乙同学所用的NH4F溶液是用塑料瓶装的,可否改用玻璃试剂瓶?____(填可或否),为什么?_______________。
(4)在FeCl3溶液中,加入适量NH4F溶液后,溶液中Fe3+浓度几乎为零,用什么方法可以检验这种说法的正确性?_____。
20、某小化工厂生产皓矾(ZnSO4·7H2O),结晶前的饱和溶液(酸性)中含有少量Cu2+、Fe3+、Fe2+等杂质。已知:0.01mol/L的Fe3+开始沉淀为Fe(OH)3到完全沉淀的pH值范围为2.7-3.7;饱和ZnSO4溶液(0.34mol/L)开始沉淀为Zn(OH)2到完全沉淀的pH值范围为5.7-8;当pH<5.6时,Na2CO3、CaCO3发生酸解生成CO2。该厂除杂质的工艺流程如下所示:
 (1)加入试剂②是_____,其作用是_____。
(2)为了调整pH值,加入试剂③,供选用的试剂有NaOH、Na2CO3、CaCO3、NH3·H2O、Ca(OH)2等,应当选用_____,其理由是_____。
(1)加入试剂②是_____,其作用是_____。
(2)为了调整pH值,加入试剂③,供选用的试剂有NaOH、Na2CO3、CaCO3、NH3·H2O、Ca(OH)2等,应当选用_____,其理由是_____。
附答案
9、氨跟氧化铜反应可以制备氮气
( ),而氮气跟镁在高温下反应可以得到氮化镁,但Mg3N2遇水即水解生成Mg(OH)2和NH3,下面是甲、乙两位学生提出的制备氮化镁的两种实验方案示意框图(实验前系统内的空气已排除;图中箭头表示气体的流向)。
),而氮气跟镁在高温下反应可以得到氮化镁,但Mg3N2遇水即水解生成Mg(OH)2和NH3,下面是甲、乙两位学生提出的制备氮化镁的两种实验方案示意框图(实验前系统内的空气已排除;图中箭头表示气体的流向)。
 (1)甲、乙两学生提出的实验方案是否能制得Mg3N2?(填能或不能)甲____,乙___。
(2)具体说明不能制得氮化镁的原因_____。
10、某溶液中含有较大量的Cl-、
(1)甲、乙两学生提出的实验方案是否能制得Mg3N2?(填能或不能)甲____,乙___。
(2)具体说明不能制得氮化镁的原因_____。
10、某溶液中含有较大量的Cl-、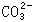 、OH-等3种阴离子,如果只取一次该溶液分别将3种阴离子一一检验出来,有下列3个实验方案:
(1)先加适量Mg(NO3)2溶液,搅拌、静置、过滤后,再向滤液中加适量Ba(NO3)2溶液,搅拌、静置、过滤后,再向滤液中加AgNO3溶液。
(2)先加适量AgNO3溶液,产生白色沉淀,过滤后再向滤液中加适量Ba(NO3)2溶液,又产生白色沉淀,再过滤,最后向滤液 中加入适量Mg(NO3)2溶液,又产生白色沉淀,再过滤,最后向滤液中加入AgNO3溶液,还生成白色沉淀。
试分析哪个实验方案能达到只取一次待测液即可分别将3种阴离子检验出来的目的,并简要说明理由:_________________。
、OH-等3种阴离子,如果只取一次该溶液分别将3种阴离子一一检验出来,有下列3个实验方案:
(1)先加适量Mg(NO3)2溶液,搅拌、静置、过滤后,再向滤液中加适量Ba(NO3)2溶液,搅拌、静置、过滤后,再向滤液中加AgNO3溶液。
(2)先加适量AgNO3溶液,产生白色沉淀,过滤后再向滤液中加适量Ba(NO3)2溶液,又产生白色沉淀,再过滤,最后向滤液 中加入适量Mg(NO3)2溶液,又产生白色沉淀,再过滤,最后向滤液中加入AgNO3溶液,还生成白色沉淀。
试分析哪个实验方案能达到只取一次待测液即可分别将3种阴离子检验出来的目的,并简要说明理由:_________________。
8、(1)写出浓硫酸与木炭粉在加热条件下反应的化学方程式________________________ (2)试用下表中所列各种装置设计一个实验来验证上述反应所产生的各种产物。这些装置的连接顺序(按产物气流从左至右的方向)是(填装置的编号):_____→_____→_____→_____。 (3)实验室可观察到装置①中A瓶的溶液褪色,C瓶的溶液不褪色。A瓶溶液的作用是________,B瓶溶液的作用是________,C瓶溶液的作用是________。 (4)装置②中所加的固体药品是_____,可确证的产物是_____,确定装置③在整套装置中位置的理由是__________。 (5)装置③中所盛溶液是_____,可验证的产物是_____。
|
编号 |
① |
② |
③ |
④ |
|
|
 |
 |
 |
 |
1、根据右图实验,填空和回答
问题。 1(1)烧瓶中所发生的主要反应的 化学方程式是______。装置Ⅱ的烧 杯中冷水所起的作用是______。装 置Ⅲ的烧杯中液体的作用是______。 (2)进行此实验时,烧瓶内的橡 皮塞最好用锡箔包住,用橡皮管连 接的两玻璃管口要相互紧靠,这是 因为_____。
(3)装置Ⅲ的烧杯中使用倒置漏斗可防止液体倒吸,试简述其原因。_____。
2、实验室用一般的气体发生装置来制备Cl2,反应物即使在停止加热后反应还会继续一段时间、当要收集多瓶Cl2时,常有较多的Cl2逸散到空气中去,为了避免Cl2的逸散,并对多余的Cl2随时取用,有人设计了如下(甲)装置来制取Cl2。
 (1)有人设计甲装置是依据了_____(填已学某仪器名称)的原理。甲中装置Ⅱ_____(填能或不能)用乙装置来代替。
(2)甲装置Ⅱ中盛有的液体是_____。该装置可看作是一个_______(填某仪器名称)。简述其主要原理,关闭活塞时,继续产生的Cl2被迫进入Ⅱ,由于Cl2在饱和食盐水中的溶解度较小,大部分Cl2充满液面上空间内,使液体压入漏斗中,保存在瓶Ⅱ的Cl2可以随时开启活塞使用。
3、实验室需要一些纯净的氯化钾,而现有的氯化钾中含有少量的KI、K2SO4和NH4Cl。现按以下方案提纯KCl,并计算不纯氯化钾样品中各组分的质量分数。
(1)有人设计甲装置是依据了_____(填已学某仪器名称)的原理。甲中装置Ⅱ_____(填能或不能)用乙装置来代替。
(2)甲装置Ⅱ中盛有的液体是_____。该装置可看作是一个_______(填某仪器名称)。简述其主要原理,关闭活塞时,继续产生的Cl2被迫进入Ⅱ,由于Cl2在饱和食盐水中的溶解度较小,大部分Cl2充满液面上空间内,使液体压入漏斗中,保存在瓶Ⅱ的Cl2可以随时开启活塞使用。
3、实验室需要一些纯净的氯化钾,而现有的氯化钾中含有少量的KI、K2SO4和NH4Cl。现按以下方案提纯KCl,并计算不纯氯化钾样品中各组分的质量分数。
 (1)给样品加热时,发生反应的化学方程式为_____,应在_____(仪器)中加热。
(2)能否用Ba(NO3)2代替BaCl2,简述理由:_____。
(3)证明
(1)给样品加热时,发生反应的化学方程式为_____,应在_____(仪器)中加热。
(2)能否用Ba(NO3)2代替BaCl2,简述理由:_____。
(3)证明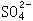 已经沉淀完全的方法是_____。
(4)过滤操作使用的仪器有_____。
(5)通足量Cl2并蒸干、灼烧的目的是_____。
(6)原样品中KI的质量分数的数学表示式为_____。
4、3位同学分别设计了下述三个实验方案,分别验证某无色气体中既含有SO2又含有CO2:
方案一:将无色气体通入酸性KMnO4溶液,KMnO4溶液褪色;反应后再将气体通入澄清石灰水,石灰水变浑浊,即可证明该无色气体中既含SO2,又含CO2。
已经沉淀完全的方法是_____。
(4)过滤操作使用的仪器有_____。
(5)通足量Cl2并蒸干、灼烧的目的是_____。
(6)原样品中KI的质量分数的数学表示式为_____。
4、3位同学分别设计了下述三个实验方案,分别验证某无色气体中既含有SO2又含有CO2:
方案一:将无色气体通入酸性KMnO4溶液,KMnO4溶液褪色;反应后再将气体通入澄清石灰水,石灰水变浑浊,即可证明该无色气体中既含SO2,又含CO2。
方案二:将无色气体通入溴水中,溴水褪色;将反应后的气体通入澄清石灰水,石灰水变浑浊,即可证明原无色气体中既含SO2,又含CO2。
方案三:将无色气体通入品红试液后,再通入酸性 KMnO4 溶液,品红褪色,KMnO4溶液颜色变浅;再将逸出的气体通入澄清石灰水,石灰水变浑浊,则证明原无色气体中既含SO2,又含CO2。
试回答:上述实验方案中,能证明该无色气体中既含有SO2,又含有CO2的方案是__________,简述其理由_____________________。
5、为验证木炭可被浓 H2SO4
氧化成二氧化碳,选用下图仪器(含所盛物质)组装成整套实验装置,试回答下列问题。
 (1)在实验进行中,按气流方向从左到右的顺序,导管口的三处连接应是_____接_____,_____接_____,_____接_____。
(2)试管B、C中应各有什么现象,才能表示已检出了CO2?B中__________,C中_________。
(3)试管D中能否用饱和NaHCO3溶液代替酸性高锰酸钾溶液?说明理由_____。
6、某亚硫酸钠试剂已部分被氧化。为确定其纯度,进行了如下实验:
①称取样品w1g;②将样品溶解;
③在溶液中加入稍过量盐酸酯化的BaCl2溶液;
④过滤、洗涤、干燥沉淀,称其质量为w2g。试回答:
(1)BaCl2要用盐酸酸化的原因_____。
(2)BaCl2溶液要稍过量的原因_____。
(3)判断操作③是否完成的方法是_____。
(4)判断沉淀是否洗净的方法是_____。
(5)Na2SO3纯度的表示为:Na2SO3%=_____。
7、工业上用硫酸亚铁固定制取颜料铁红(Fe2O3),反应原理是
(1)在实验进行中,按气流方向从左到右的顺序,导管口的三处连接应是_____接_____,_____接_____,_____接_____。
(2)试管B、C中应各有什么现象,才能表示已检出了CO2?B中__________,C中_________。
(3)试管D中能否用饱和NaHCO3溶液代替酸性高锰酸钾溶液?说明理由_____。
6、某亚硫酸钠试剂已部分被氧化。为确定其纯度,进行了如下实验:
①称取样品w1g;②将样品溶解;
③在溶液中加入稍过量盐酸酯化的BaCl2溶液;
④过滤、洗涤、干燥沉淀,称其质量为w2g。试回答:
(1)BaCl2要用盐酸酸化的原因_____。
(2)BaCl2溶液要稍过量的原因_____。
(3)判断操作③是否完成的方法是_____。
(4)判断沉淀是否洗净的方法是_____。
(5)Na2SO3纯度的表示为:Na2SO3%=_____。
7、工业上用硫酸亚铁固定制取颜料铁红(Fe2O3),反应原理是
 课外活动小组在实验室作这一实验时,为除去混合气体中的SO3得到纯净的SO2气体,应选用下列哪种装置,请将标号及实验原理填入下表:(SO2的沸点为-10.02℃)
课外活动小组在实验室作这一实验时,为除去混合气体中的SO3得到纯净的SO2气体,应选用下列哪种装置,请将标号及实验原理填入下表:(SO2的沸点为-10.02℃)

|
选用装置(标号) |
简答实验原理 |
|
|
|
|
|
|
1、结晶水的存在不能得到甲烷
2、在CH2==CH2中常混有SO2,SO2可被Br2和KMnO4氧化,干扰CH2==CH2与Br2的加成反应及CH2==CH2被KMnO4氧化的实验准确性。
3、(1)NaOH和H2S发生中和反应;现象不明显,酸碱中和反应放热,由于Na2S的水解,未能完全除去H2S。(2)KMnO4氧化H2S;KMnO4也氧化C2H2。(3)CuSO4与H2S反应生成CuS沉淀;现象明显,CuSO4不与C2H2反应。(4)Pb(CH3COO)2
4、HNO3的沸点比硝基苯低,Br2的沸点比溴苯低,易挥发损失,为提高原料利用率,应装回流装置。凡由低沸点原料制高沸点产物时,均应考虑安装回流装置。
5、在溴苯中溶有Br2而呈红褐色,可用稀NaOH溶液洗涤后分液,得到较纯净溴苯。
6、浓H2SO4 浓HNO3 水浴中,
 (1)防止温度过高,导致苯的挥发和硝酸的分解。
(2)避免副反应的发生 冷水
7、C2H6、C3H6、C4H6 不存在,依题意X、Y、Z中至少有一种气态烃分子里的氢原子为奇数,而由烷、烯、炔的通式可知不可能。
(1)防止温度过高,导致苯的挥发和硝酸的分解。
(2)避免副反应的发生 冷水
7、C2H6、C3H6、C4H6 不存在,依题意X、Y、Z中至少有一种气态烃分子里的氢原子为奇数,而由烷、烯、炔的通式可知不可能。
 (4)均为加成反应。由于电子云偏向于N原子,使其共轭体系不稳定,且N为负电荷中心,B为正电荷中心。
9、当A为烃时,B为烃的含氧衍生物,在A、B的分子中含有的氢原子数相同,且相差n个碳原子时,必同时相差2n个氧原子。
(4)均为加成反应。由于电子云偏向于N原子,使其共轭体系不稳定,且N为负电荷中心,B为正电荷中心。
9、当A为烃时,B为烃的含氧衍生物,在A、B的分子中含有的氢原子数相同,且相差n个碳原子时,必同时相差2n个氧原子。
 有同分异构体;羧基为1价基,只能在链端,酮基为2价基,只能在链中,这些均不可改变,但羟基的氧原子可连在两碳原子中间,形成新的同分异构体。如:
有同分异构体;羧基为1价基,只能在链端,酮基为2价基,只能在链中,这些均不可改变,但羟基的氧原子可连在两碳原子中间,形成新的同分异构体。如:
 10、(1)(CO)m(H2O)A。 (2)CO (3)m:n=1:1 P为任意值。
10、(1)(CO)m(H2O)A。 (2)CO (3)m:n=1:1 P为任意值。
 (3)无影响;异丙醇发生消去反应同样生成丙烯。
12、(1)CnH2nO。
(2)醇分子含有一个碳碳双键或一个碳环。
(3)A.
(3)无影响;异丙醇发生消去反应同样生成丙烯。
12、(1)CnH2nO。
(2)醇分子含有一个碳碳双键或一个碳环。
(3)A. (或其它碳环醇)、
CH2==CHCH2CH2CH2OH(或其它五碳烯醇)。
(或其它碳环醇)、
CH2==CHCH2CH2CH2OH(或其它五碳烯醇)。
 -COOH和酚羟基均具有酸性,可与NaOH生成盐,醇羟基不能与NaOH反应。
-COOH和酚羟基均具有酸性,可与NaOH生成盐,醇羟基不能与NaOH反应。
 酚羟基的酸性极弱,不能跟Na2CO3或NaHCO3反应,只有-COOH跟NaHCO3反应。
酚羟基的酸性极弱,不能跟Na2CO3或NaHCO3反应,只有-COOH跟NaHCO3反应。
 醇羟基、酚羟基、羧基均可与Na发生置换反应,放出氢气。
14、(1)CH3-CH3-OH或CH3-O-CH3
醇羟基、酚羟基、羧基均可与Na发生置换反应,放出氢气。
14、(1)CH3-CH3-OH或CH3-O-CH3
 (3)CH3-CH3,该有机物分子中只能含有2个碳原子,6个氢原子,若为烃时只能是乙烷,若为烃的含氧衍生物时可能是乙醇、甲醚、乙二醇。1mol乙醇(甲醚)燃烧耗氧3mol,乙二醇完全燃烧耗氧2.5mol,乙烷完全燃烧耗氧3.5mol。
(3)CH3-CH3,该有机物分子中只能含有2个碳原子,6个氢原子,若为烃时只能是乙烷,若为烃的含氧衍生物时可能是乙醇、甲醚、乙二醇。1mol乙醇(甲醚)燃烧耗氧3mol,乙二醇完全燃烧耗氧2.5mol,乙烷完全燃烧耗氧3.5mol。
 (2)酸性 苯磺酸>亚硫酸>苯酚。较强的酸与较弱的酸的盐反应可得较弱的酸。
(2)酸性 苯磺酸>亚硫酸>苯酚。较强的酸与较弱的酸的盐反应可得较弱的酸。
 (2)使分液漏斗与烧瓶中气压相等,便于盐酸滴下
(3)饱和食盐水,浓硫酸,进入到D的Cl2中将有水蒸气
(4)观察C、E中气泡上升的速度大约相等,表明1体积Cl2经取代后生成1体积HCl。
(5)有黄色,因有FeCl3随HCl的溶解而介入
17、新制Cu(OH)2悬浮在溶液中,与醛分子接触面积大,容易反应。配制已久的Cu(OH)2结合很紧密,与醛分子接触面积小,难以将醛氧化。醛与Cu(OH)2反应生成乙酸,过量的NaOH可中和乙酸,减少副反应发生。
18、因NaOH溶液碱性很强,会使乙酸乙酯水解,重新变成乙酸和乙醇,所以不能用NaOH溶液代替Na2CO3饱和溶液。
19、加入足量NaOH溶液蒸馏,取馏分与Cu(OH)2加热至沸腾,若有红色沉淀则证明甲酸溶液中混有甲醛。
20、(1)-COOH既能和Na反应,又能和Na2CO3反应,如生成H2和CO2的体积相等,则一元羧酸、二元羧酸都可以。
如CnH2n+1COOH、HOOC-(CH2)n-COOH等。
(2)VA>VB,即H2体积大于CO2的体积,说明该有机物不仅有-COOH,而且还有-OH,它们都能和Na反应放出H2,但只有-COOH才能与Na2CO3反应放出CO2,因要求VA=2VB,所以通式可以为HO-(CH2)n-COOH
(3)由以上说明可知,VA<VB,的有机物是没有的。因为在有机物中凡能和
(2)使分液漏斗与烧瓶中气压相等,便于盐酸滴下
(3)饱和食盐水,浓硫酸,进入到D的Cl2中将有水蒸气
(4)观察C、E中气泡上升的速度大约相等,表明1体积Cl2经取代后生成1体积HCl。
(5)有黄色,因有FeCl3随HCl的溶解而介入
17、新制Cu(OH)2悬浮在溶液中,与醛分子接触面积大,容易反应。配制已久的Cu(OH)2结合很紧密,与醛分子接触面积小,难以将醛氧化。醛与Cu(OH)2反应生成乙酸,过量的NaOH可中和乙酸,减少副反应发生。
18、因NaOH溶液碱性很强,会使乙酸乙酯水解,重新变成乙酸和乙醇,所以不能用NaOH溶液代替Na2CO3饱和溶液。
19、加入足量NaOH溶液蒸馏,取馏分与Cu(OH)2加热至沸腾,若有红色沉淀则证明甲酸溶液中混有甲醛。
20、(1)-COOH既能和Na反应,又能和Na2CO3反应,如生成H2和CO2的体积相等,则一元羧酸、二元羧酸都可以。
如CnH2n+1COOH、HOOC-(CH2)n-COOH等。
(2)VA>VB,即H2体积大于CO2的体积,说明该有机物不仅有-COOH,而且还有-OH,它们都能和Na反应放出H2,但只有-COOH才能与Na2CO3反应放出CO2,因要求VA=2VB,所以通式可以为HO-(CH2)n-COOH
(3)由以上说明可知,VA<VB,的有机物是没有的。因为在有机物中凡能和 作用生成CO2的官能团一定能和Na反应生成H2。
21、(1)聚甲基丙烯酸甲酯
作用生成CO2的官能团一定能和Na反应生成H2。
21、(1)聚甲基丙烯酸甲酯
 (3)在碱性条件下平衡
(3)在碱性条件下平衡 向右移动,[CN-]增大,反应速率加快。
向右移动,[CN-]增大,反应速率加快。
 乙烯氧化法即②,流程简单,原料丰富,成本低,且产率高。
23、羧酸脱水为酐,是由一个-COOH中的-H与另一个-COOH中的-OH结合成H2O脱去,HCOOH脱水生成CO,是由-COOH中的-OH和HCO-中的H原子结合成水脱去,且CO不与H2O化合成甲酸。
24、(1)隔绝空气,防止钠被氧化。不可以,因为CCl4密度大,金属钠会浮在上面。
(2)有水存在时会与钠反应,生成NaOH会促使乙酸乙酯水解。冷凝回流,防止空气中水蒸气进入反应体系。
(3)使乙酰乙酸乙酯与乙醇分层。分液漏斗。
(4)除去乙酰乙酸乙酯中的水。这是一个可逆反应,反应到一定程度即达平衡状态,不可能全部转化。
乙烯氧化法即②,流程简单,原料丰富,成本低,且产率高。
23、羧酸脱水为酐,是由一个-COOH中的-H与另一个-COOH中的-OH结合成H2O脱去,HCOOH脱水生成CO,是由-COOH中的-OH和HCO-中的H原子结合成水脱去,且CO不与H2O化合成甲酸。
24、(1)隔绝空气,防止钠被氧化。不可以,因为CCl4密度大,金属钠会浮在上面。
(2)有水存在时会与钠反应,生成NaOH会促使乙酸乙酯水解。冷凝回流,防止空气中水蒸气进入反应体系。
(3)使乙酰乙酸乙酯与乙醇分层。分液漏斗。
(4)除去乙酰乙酸乙酯中的水。这是一个可逆反应,反应到一定程度即达平衡状态,不可能全部转化。
 (2)CH3COOH>H-OH>C2H5OH
在含-OH的分子中,-OH中氢氧键的极性越强,与钠发生置换放出氢气的速度越快。
26、(1)CH3-CH==CH2+HCl─→CH3CHClCH3
丙烯可视为乙烯的甲基取代物,由于甲基是斥电子基,使“C=C”的电子云向甲基推斥方向移动,即CH3→CH==CH2,使HCl中带正电荷的氢原子加到带部分负电荷的双键碳原子上,带负电荷的氯原子加到带部分正电荷的碳原子上。
(2)甲酸酸性比乙酸酸性强,因甲基推斥电子减弱了羟基氧氢键的极性。
(3)氯乙酸的酸性比乙酸酸性强,因氯原子具有强烈吸引电子能力,加强了羟基中氧氢键的极性。
27、未加NaOH溶液中和酸,酸溶解了Cu(OH)2。
28、取水解液中至中性,加入新制Cu(OH)2加热,有砖红色沉淀说明开始转化为葡萄糖。取水解液加入碘单质,如不变蓝说明水解完全。
29、随温度升高,酶催化作用显著,加快反应速度;A点后温度使蛋白质受热凝固,失去活性,使反应速度下降。
(2)CH3COOH>H-OH>C2H5OH
在含-OH的分子中,-OH中氢氧键的极性越强,与钠发生置换放出氢气的速度越快。
26、(1)CH3-CH==CH2+HCl─→CH3CHClCH3
丙烯可视为乙烯的甲基取代物,由于甲基是斥电子基,使“C=C”的电子云向甲基推斥方向移动,即CH3→CH==CH2,使HCl中带正电荷的氢原子加到带部分负电荷的双键碳原子上,带负电荷的氯原子加到带部分正电荷的碳原子上。
(2)甲酸酸性比乙酸酸性强,因甲基推斥电子减弱了羟基氧氢键的极性。
(3)氯乙酸的酸性比乙酸酸性强,因氯原子具有强烈吸引电子能力,加强了羟基中氧氢键的极性。
27、未加NaOH溶液中和酸,酸溶解了Cu(OH)2。
28、取水解液中至中性,加入新制Cu(OH)2加热,有砖红色沉淀说明开始转化为葡萄糖。取水解液加入碘单质,如不变蓝说明水解完全。
29、随温度升高,酶催化作用显著,加快反应速度;A点后温度使蛋白质受热凝固,失去活性,使反应速度下降。
29、 酶是蛋白质,具有蛋白质的
特性,酶能催化很多化学反应,右
图中表示为酶参加的反应中,温度
与反应速率的关系,解释曲线变化
酶是蛋白质,具有蛋白质的
特性,酶能催化很多化学反应,右
图中表示为酶参加的反应中,温度
与反应速率的关系,解释曲线变化
的原因_____。
附答案
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com