
题目列表(包括答案和解析)
3. 尿酸是人体的一种代谢产物,关节炎形成的原因就是在关节的滑液中形成尿酸钠(通常用NaUr表示)晶体:
HUr+H2O====Ur -+H3O+ ① Ur -+Na+====NaUr ②
第一次关节炎发作的时间大都在寒冷季节,发病部位常常是手指的关节处,下列推测正确的是
A.反应②是吸热反应 B.热敷可以使关节炎的症状减轻有一定的道理
C.NaUr易溶于水 D.关节炎发病时关节滑液的pH降低
2.下列分子中的所有碳原子不可能处在同一平面上的是
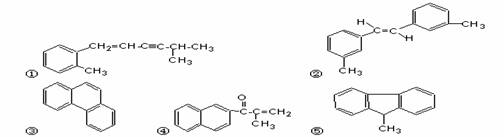
A.②③ B.①④③ C.①②④ D.①⑤
1.三国时代,诸葛亮领兵南征孟获,遇到了“哑泉”,士兵饮后致哑,腹痛,甚至死亡。又有一“安乐泉”饮后可解“哑泉”之毒。1995年10月国内某报刊报道,经科研人员研究,“哑泉”水中溶有CuS04,“安乐泉”水质偏碱性。下列有关说法可能符合题意的是
①“哑泉”之毒是由于水中的Cu2+使人体中的蛋白质变性
②“哑泉”之毒是由于水中的SO42-使人体中的蛋白质变性
③“哑泉”之毒是由于水中的Cu2+水解显酸性使人体中的蛋白质变性
④“安乐泉”能解“哑泉”之毒的离子方程式为CU2++2 OH-=Cu(OH)2↓
A.①④ B.②④ C.③ D.均不正确
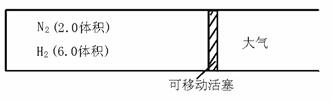
4.(★★★★★)在一定温度下,把2.0体积N2和6.0体积H2通入一个带活塞的体积可变的容器中,活塞的一端与大气相通,如图20-2所示。容器中发生的反应如下:
N2+3H2 2NH3(正反应放热)
图20-2
2NH3(正反应放热)
图20-2
若反应达到平衡后,测得混合气体为7.0体积。试回答:
(1)保持上述反应温度不变,设a、b、c(a∶b=1∶3)分别代表初始加入的N2、H2和NH3的体积,如果反应达到平衡后,混合气体中各物质的体积分数仍与上述平衡完全相同。那么:
①若a=1.0,c=2.0,则b=___________。在此情况下,反应起始时将向___________方向进行(填“正”或“逆)。
②若规定起始时反应向逆方向进行,则c的范围是__________________。(用含a、b的式子表示)。
(2)在上述装置中,若需控制平衡后混合气体为6.5体积,则可采取的措施是__________,原因是___________________________________。
3.(★★★★)在一个固定体积的密闭容器中,保持一定温度,进行以下反应:
H2(g)+Br2(g)
 2HBr(g)
2HBr(g)
已知加入1 mol H2和2 mol Br2时,达到平衡后生成a mol HBr(见下表的“已知”项),在相同条件下,且保持平衡时各组分的含量不变,对下列编号(1)-(3)的状态,填写表中的空白。
|
编号 |
起始状态(mol) |
平衡时HBr(g) 物质的量(mol) |
||
|
H2 |
Br2 |
HBr |
||
|
已知 |
1 |
2 |
0 |
a |
|
(1) |
2 |
4 |
0 |
|
|
(2) |
|
|
1 |
0.5 a |
|
(3) |
m |
n(n≥2m) |
|
|
2.(★★★★)在一固定容积的密闭容器中,充入2.0 mol A和1.0 mol B发生如下反应:
2A(g)+B(g)  xC(g)
xC(g)
达到平衡后,C的体积分数为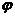 (C)。若维持容器体积和温度不变,改为充入0.6 mol A、0.3 mol B和1.4
mol C为起始物质,反应达平衡后,C的体积分数也为
(C)。若维持容器体积和温度不变,改为充入0.6 mol A、0.3 mol B和1.4
mol C为起始物质,反应达平衡后,C的体积分数也为 (C),则x可能为( )
(C),则x可能为( )
A.1 B.2 C.3 D.4
1.(★★★)将2.0
mol SO2气体和2.0 mol SO3气体混合于固定体积的密闭容器中,在一定条件下发生反应:2SO2(g)+O2(g)  2SO3(g),达到平衡时SO3为n mol。在相同温度下,分别按下列配比在相同密闭容器中放入起始物质,平衡时SO3等于n mol的是( )
2SO3(g),达到平衡时SO3为n mol。在相同温度下,分别按下列配比在相同密闭容器中放入起始物质,平衡时SO3等于n mol的是( )
A.1.6 mol SO2+0.3 mol O2+0.4 mol SO3
B.4.0 mol SO2+1.0 mol O2
C.2.0 mol SO2+1.0 mol O2+2.0 mol SO3
D.3.0 mol SO2+1.0 mol O2+1.0 mol SO3
2.恒温恒压条件下的等效平衡
恒温恒压条件下,建立等效平衡的条件是:相同反应物的投料比相等。若投料物质不相同时,可依反应方程式完全转化后作比较。如3 L带活塞的甲、乙两容器,保持 t℃和1标准大气压,甲中投入2 mol N2和5 mol H2,乙中投入4 mol N2和10 mol H2,建立平衡时,两容器中NH3体积分数相等。
●歼灭难点训练
1.恒温恒容条件下的等效平衡
恒温恒容条件下,建立等效平衡的条件是:反应物投料量相当。如在t℃的V L恒温恒容甲、乙两容器中,甲中投入2 mol SO2和1 mol O2,乙中投入2mol SO3,平衡时两容器中SO3的体积分数相等。
若某平衡反应为:
mA(g)+nB(g)  pC(g)+qD(g)
pC(g)+qD(g)
且m+n=p+q,则压强对平衡无影响,这时建立等效平衡的条件是:相同反应物的投料比相等;若投料物质不一样时,可依反应方程式转化后再作比较。如温度t℃、体积为V L的甲、乙两恒温恒容容器中,甲中充入1 mol的I2蒸气和1 mol的H2,乙中充入3 mol的I2蒸气和3 mol的H2,那么平衡时,甲、乙两容器中HI的体积分数相同。
4.(★★★★★)在100 g 浓度为 18 mol·L-1密度为ρ(g/cm3)的浓硫酸中加入一定量的水稀释成 9 mol·L-1的硫酸,则加入水的体积为( )
A.<100 mL B.=100 mL C.>100 mL D.=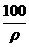 mL
mL
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com