
题目列表(包括答案和解析)
2.“空对空”响尾蛇导弹头部的“红外眼睛”,能分辩出0.001℃的温差变化,它是由热敏陶瓷材料和热释电陶瓷材料做成的。下列叙述中不正确的是 ( )
A.“红外眼睛”对热非常敏感
B.“红外眼睛”的热目标是敌机发动机或尾部喷口高温区
C.“红外眼睛”的电阻值随温度明显变化
D.“红外眼睛”的工作原理与人眼相同
1.臭氧分子的结构与SO2(极性分子)相似,可读做二氧化氧,在臭氧层中含量达0.2ppm(ppm表示百万分之一)。臭氧是氧气吸收了太阳的波长小于220nm的紫外线形成的,不过当波长在220 nm-320 nm的紫外线照射臭氧时,又会使其分解。下列说法中正确的是
A.打雷时也能产生臭氧,臭氧分子是直线型分子
B.臭氧转化为氧气和氧气转化为臭氧均须吸收能量
C.臭氧和氧气的相互转化能保持大气中臭氧的含量基本稳定
D.向大气中排放硫、氮的氧化物和氟氯代烃均能抑制臭氧的分解
21、解析:(1)上述反应打用逆向配平(歧化反应,铜元素化合价既升高又降低)缺项显然为(NH4)2SO4 ,各计量系数依次为2,2,1,2,1,2,1。
(2)2molCu (NH4)SO3中的铜1mol转化为单质铜,1mol转化为CuSO4,因此,转化率为50%。
(1)若在密闭容器中进行,为何铜的转化率会提高?显然Cu(I)自身岐化转化率只能为50%,必有其它还原剂才能提高其转化率。由于产物中含SO2,SO2具有强还原性,能将Cu(II)还原为零价。其最高转化率可达100%,原因是:每生成1molCuSO4可生成2molSO2,它可提供4mol电子,完全可将CuSO4还原且SO2仍过量。
19.(1) ①如图配置
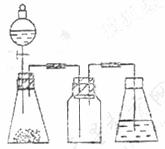
②打开分液漏斗上口的活塞,旋开分液漏斗的旋塞,缓慢滴加。
(2) ①溶液褪色
②溶液褪色
③有浅黄色沉淀(或溶液变浑浊)
(3)①NaSO3 变质
取待测试样于试管中,加适量蒸馏水配成溶液,先滴入足量稀盐酸,再滴入BaCl2 ,溶液有白色沉淀生成,则证明该NaSO3 固体变质
②不是浓硫酸
用洁净玻璃棒蘸取待测试样,涂白纸不变黑,则证明该溶液不是浓硫酸
20(1)NH4+、Fe2+,SO42-)
(2) 该结晶水合物的化学式为(NH4)2Fe(SO4)2•6H2O [或(NH4)2SO4•FeSO4•6H2O]
21、白色的亚铜化合的Cu(NH4)SO3难溶于水,若与足量的10mol·L-1的硫酸溶液混合并微热,生成铜和SO2气体及溶液。
(1)完成并配平化学方程式:Cu(NH4)SO3+ H2SO4--Cu+ SO2+ CuSO4+
(2)按上述操作,铜的最高转化率是多少_______________
(3)有人设计让上述实验在密闭容器中进行,结果铜的转化率大大提高,问在密闭容器中进行反应,铜的最高转化率是 ?
17
CO2、H2O、H2S、O2、H2
(2)略
(3)3O2+2H2S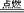 2SO2+2H2O
(4)H2O(气)+CO(气)
2SO2+2H2O
(4)H2O(气)+CO(气)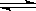 CO2(气)+H2(气);不移动;高温下化合物B为气体,反应前后气体的总体积不变。
CO2(气)+H2(气);不移动;高温下化合物B为气体,反应前后气体的总体积不变。
18(1)H2S、CO2、H2、O2 NO2、Cl2、NO、SO2、NH3 (2)40.3
20、某结晶水合物含有两种阳离子和一种阴离子。称取两份质量均为1.96g的该结晶水合物,分别制成溶液。一份加入足量Ba(OH)2溶液,生成白色沉淀,随即沉淀变为灰绿色,最后带有红褐色;加热该混合物,逸出能使湿润的红色石蕊试纸变蓝的气体;用稀盐酸处理沉淀物,经洗涤和干燥,得到白色固体2.33 g。另一份加入含0.001 molKMnO4的酸性溶液,MnO4-恰好完全被还原为Mn2+。 请回答以下问题:M(BaSO4)=233g/mol
(1)该结晶水合物中含有的两种阳离子是 和 ,阴离子是 。
(2)试通过计算确定该结晶水合物的化学式 。
19、研究性学习小组进行SO2的制备及性质探究实验。
(1)根据反应Na2SO3(固)+H2SO4(浓)= Na2SO4 + SO2↑+ H2O ,制备SO2气体。
①用下列简图,在答题卡的方框中画出制备并收集SO2的实验装置(含试剂)示意图。
②实验过程中,使用分液漏斗滴加浓硫酸的操作是___ _____________
。
(2)将SO2气体分别通入下列溶液中:
①品红溶液,现象是_______________________________ _____;
②溴水溶液,现象是___________________________________________;
③硫化钠溶液,现象是_________________________________________。
(3)有一小组在实验中发现,SO2气体产生缓慢,以致后续实验现象很不明显,但又不存在气密性问题。请你推测可能的原因并说明相应的验证方法(可以不填满)。
① 原因_____________________;验证方法______________ ______ ___。
② 原因_____________________;验证方法 ___________________ 。
③原因_____________________;验证方法________________________。
18.常温下干燥的混合气体可能由H2S、H2、Cl2、SO2、NH3、NO2、NO、CO2和O2中的某几种组成,进行以下实验:
① 混合气体无色,其密度比空气密度大。
②混合气体不能使湿润的品红试纸褪色,打开瓶塞无颜色变化。
③混合气体通过浓硫酸时有浑浊,但气体体积不变,再通过碱石灰,气体体积缩小到原来的10%。
④上述通过碱石灰的混合气体,若点燃会爆炸,恢复到常温时剩余气体体积为通过浓H2SO4和碱石灰之前的原混合气体的2.5%,若使其通过赤热的铜网,铜网表面变黑。
⑤当原混合气体通过CuSO4溶液时,剩余气体为原来的90%。
根据以上实验回答:
(1)原混合气体中一定含有 ,一定不含 。
(2)原混合气体的相对平均分子质量为 。
17、A、B、C、D是中学化学中常见的四种化合物,它们分别由两种元素组成.甲、乙、丙是单质,甲、丙、A、C、D常温下均为气体,B为液体。这些单质和化合物之间存在如下关系:
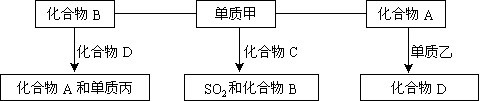
(1)写出下列物质的分子式:A_____、B_____、C_____、甲_____、丙_____。
(2)写出下列物质的电子式:A_______、B_______、C_______。
(3)写出单质甲跟化合物C反应,生成SO2和化合物B的化学方程式
(4)在密闭容器中,化合物B跟化合物D在高温下生成化合物A和单质丙的反应是可逆反应,其化学方程式H2O(g)+CO(g)==CO2(g)+H2(g);反应达平衡后,若增大体系的压强,该平衡______________(填向左移动、向右移动、不移动);其理由是
16、将一定质量的金属Zn跟100mL,18.0mol/L的浓硫酸在加热条件下充分反应。发现Zn完全溶解,生成的气体在标准状况下所占的体积为11.2L。将反应后的溶液稀释成1L,测得溶液中H+离子的物质的量浓度为2mol/L。则所生成气体中二氧化硫与氢气的体积比为
A、1:2 B、2:1 C、3:2 D、2:3
高三化学《氧族元素》单元测试卷2005-11-23
班级 座号 姓名 成绩
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com