
题目列表(包括答案和解析)
2.(★★★★)常温下,在pH都等于9的NaOH和CH3COONa两种溶液中,设由水电离产生的OH-浓度分别为A mol·L-1与B mol·L-1,则A与B的关系为( )
A.A>B B.A=10-4 B
C.B=10-4A D.A=B
1.(★★★)水是一种极弱的电解质,在室温下平均每n个水分子中只有1个分子发生电离,则n值是( )
A.107 B.5.56×108
C.1.0×10-14 D.55.6
3.对所有盐溶液而言都可根据溶质的分子组成列出一个阴、阳离子浓度的关系式。
●歼灭难点训练
2.强碱弱酸盐溶液中:
c(OH-)=c(H+)+c(被弱酸根结合的H+)
1.强酸弱碱盐溶液中:
c(H+)=c(OH-)+c(被弱碱阳离子结合的OH-)
3.盐溶液中,c水(H+)、c水(OH-)的求解规律:
(1)常温下,强碱弱酸盐溶液中,c水(H+)或c水(OH-)的求解规律分别是
c水(OH-)=10pH-14
c水(H+)=c溶液(H+)+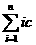 [HiA(n-i)-]=10-pH+
[HiA(n-i)-]=10-pH+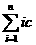 [HiA (n-i)-]
[HiA (n-i)-]
(An-代表弱酸根离子)
(2)常温下,强酸弱碱盐溶液中,c水(H+)、c水(OH-)的求解规律分别是
c水(H+)=10-pH
c水(OH-)=c溶液(OH-)+c[M(OH)n-1]
(Mn+代表弱碱阳离子)
2.碱溶液中:
c水(OH-)·c碱(OH-)=Kw[或c水(OH-)= 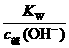 ]
]
对于弱碱中的氨水溶液:
c水(OH-)=
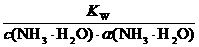
1.强酸溶液:
c水(H+)×c酸(H+)=Kw[或c水(H+)=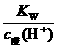 ]
]
弱酸溶液中:
c水(H+)=

4.(★★★★★)已知 NH3 和 Cl2 相遇,发生下列反应:
①8NH3+3Cl2 ==== N2+6NH4Cl (NH3过量)
②2NH3+3Cl2==== N2+6HCl (Cl2过量)
今向过量的 NH3 中通入少量的 Cl2。若开始时 Cl2、NH3 混和气体中 Cl2 的体积分数为 x,混合气体反应前后的体积分别是 a L 和 y L。则:
(1)x 的取值范围是__________________;
(2)y 与x 的函数关系是__________________。
3.(★★★★)总压强为 3.0×107 Pa 时,N2、H2 混合气体(体积之比为 1∶3)通入合成塔中,反应达平衡时,压强降为 2.5×107 Pa,则平衡时混合气体中 NH3 的体积分数为( )
A.35% B.30% C.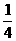 D.
D.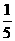
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com