
题目列表(包括答案和解析)
21.(10分)
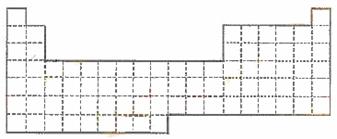
(1) 在上面元素周期表中画出金属元素与非金属元素的分界线。
(2)有人认为形成化合物最多的元素不是IVA族的碳元素,而是另一种短周期元素,请你根据学过的化学知识判断这一元素是 。
(3)现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等。
① 用元素符号将甲、乙两元素填写在上面元素周期表中对应的位置。
② 用反应方程式各举一例,甲、乙两元素分别与氧化物反应
, 。
20.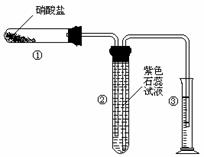 (12分)某校化学兴趣小组的同学对硝酸盐的受热分解进行探究。他们设计了如下装置分别加热了NaNO3、Cu(NO3)2、AgNO3。(加热及夹持装置未画出)
(12分)某校化学兴趣小组的同学对硝酸盐的受热分解进行探究。他们设计了如下装置分别加热了NaNO3、Cu(NO3)2、AgNO3。(加热及夹持装置未画出)
(1) 甲同学加热的是NaNO3。加热过程发现:装置②中产生气泡,部分石蕊试液被压至装置③中;用带火星的木条检验②中的气体,木条复燃;分析装置①中剩余的固体得知,剩余固体中含有N元素,且显+3价。请写出NaNO3受热分解的化学方程
式: ;
(2) 乙同学加热的是Cu(NO3)2。加热过程发现:装置②中也有气泡产生,但在上升的过程中消失。石蕊试液逐渐变为红色,液体几乎不被压至装置③中。装置①中的固体逐渐变为黑色。请写出Cu(NO3)2受热分解的化学方程
式: ;
(3)丙同学加热的是AgNO3。加热过程发现:装置②中也有气泡产生,但在上升的过程中气泡部分消失,剩余的气体也能使带火星的木条复燃。石蕊试液也逐渐变为红色,有少量液体被压至装置③中。装置①中的固体逐渐变为黑色。丙同学据此写出了AgNO3受热分解可能的两种化学方程式:
(Ⅰ)4AgNO3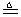 2Ag2O+4NO2↑+O2↑,(Ⅱ) 2AgNO3
2Ag2O+4NO2↑+O2↑,(Ⅱ) 2AgNO3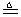 2Ag+2NO2↑+O2↑。请你分析,可能正确的是哪一个并说明理
2Ag+2NO2↑+O2↑。请你分析,可能正确的是哪一个并说明理
由: ;
请你设计一个简单的实验证明你的结论是正确的:
;
(4)由上述3个实验的结果,请你推测:硝酸盐受热分解的产物可能与
有关。
19.(8分)(1)右图是某学生设计的制取和收集某些气体的实验装置(可加热)。
若用排空气法收集,可使用该装置制备和收集的是_____________;若用排水法收集(集气瓶中充满水), 可使用该装置制备和收集的是____________(均填编号)。
A.用Zn与稀盐酸反应制H2 B.用MnO2与双氧水反应制O2
C.用MnO2与浓HCl反应制Cl2 D.用MnO2与KClO3反应制O2 E.用CaCO3与稀盐酸反应制CO2 F.用Cu与稀HNO3反应制NO G.用固体NH4C1和消石灰制NH3
(2) 下列仪器中:①漏斗②容量瓶③蒸馏烧瓶④天平⑤分液漏斗⑥滴定管⑦燃烧匙,常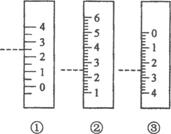 用于物质分离的是_________(填编号)。
用于物质分离的是_________(填编号)。
(3)右图是温度计、量筒、滴定管的一部分,下述读数(虚线刻度)及说法正确的是__________
A.①是量筒,读数为2.5mL
B.②是量筒,读数为2.5mL
C.③是滴定管,读数为2.5mL
D.②是温度计,读数是2.5℃
18.将质量为w1g的钠、铝混合物投入一定量的水中充分反应,金属没有剩余,共收集到标准状况下的气体V1 L。向溶液中逐滴加入浓度为a mol/L的HCl溶液,过程中有白色沉淀生成后又逐渐溶解,当沉淀恰好消失时所加HCl溶液体积为V2 L。将溶液蒸干灼烧得固体w2g。下列所列关系式中正确的是
A. 35.5a V2 =w2-w1 B. 23n(Na)+27n(Al)=w1
C. n(Na)+3n(Al)=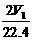 D. a V2 =
D. a V2 =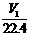
第Ⅱ卷(非选择题 共78分)
17.MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如右图所示。下列叙述中不正确的是
 A、ROH是一种强碱
A、ROH是一种强碱
B、在x点,MOH完全电离
C、在x点,C(M+)=C(R+)
D、稀释前,C(ROH)=10C(MOH)
16.在一密闭容器中,反应mA(g)+nB(s)  3C(g)达到平衡时,测得C(A)为0.5 mol/L在温度不变的情况下,将容积增大一倍,当达到新的平衡时,测得C(A)为0.3 mol/L,则下列判断正确的是
3C(g)达到平衡时,测得C(A)为0.5 mol/L在温度不变的情况下,将容积增大一倍,当达到新的平衡时,测得C(A)为0.3 mol/L,则下列判断正确的是
A、混合气体密度一定减小 B、平衡一定向逆反应方向移动
C、化学计量数:m+n>3 D、物质C的体积分数增加了
15.下列各选项所述的两个量,前者一定大于后者的是
①HF和HBr的沸点,②纯水在25℃和80℃时的pH,③同温下分别在100g水中最多能溶解的无水CuSO5和CuSO5·5H2O的质量,④25℃时,等体积的pH都等于3的盐酸和AlCl3溶液中,已电离的水分子数,⑤在NH3+NO→N2+H2O反应中,被氧化和被还原的N原子数,⑥耐火材料MgO和CaO的熔点,⑦H-和H+离子半径,⑧金刚石晶体和石墨晶体中,每个最小碳环里所含的实际碳原子数
A、①②⑥ B、①②③⑤ C、⑤⑥⑦ D、①②⑥⑦
14.在一定条件下,固定容积的密闭容器中反应:2NO2(g) O2(g)+2NO(g);DH>0,达到平衡。当改变其中一个条件X,Y随X的变化符合图中曲线的是
O2(g)+2NO(g);DH>0,达到平衡。当改变其中一个条件X,Y随X的变化符合图中曲线的是
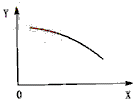
A. 当X表示温度时,Y表示NO2的物质的量
B. 当X表示压强时,Y表示NO2的转化率
C. 当X表示反应时间时,Y表示混合气体的密度
D. 当X表示NO2的物质的量,Y表示O2的物质的量
13.下列反应的现象描述与离子方程式都正确的是
A. 金属镁与稀盐酸反应:有氢气产生;Mg+2H++2Cl- =MgCl2+H2↑
B. 氯化钡溶液与硫酸反应:有白色沉淀生成;Ba2+ +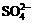 =BaSO4¯
=BaSO4¯
C. 碳酸钠溶液与盐酸反应:有气泡生成:Na2CO3+2H+=2Na++CO2+H2O
D. 过量铁粉与氯化铁溶液反应:溶液变成浅绿色:Fe+Fe3+=2Fe2+
12.下列说法或表示方法中正确的是
A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
B.由C(金刚石)→C(石墨);ΔH=+119KJ/mol 可知,金刚石比石墨稳定
C.在101Kpa时,2gH2完全燃烧生成液态水,放出285.8KJ热量,氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l);ΔH=+285.8KJ/mol
D.在稀溶液中:H+(aq)+OH-(aq)=H2O(l);ΔH=-53.7KJ/mol ,若将含0.5 molH2SO4的浓溶液与含1 molNaOH的溶液混合,放出的热量大于53.7KJ/mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com