
题目列表(包括答案和解析)
5. 下列叙述中正确的是 ( )
A. 同温同压下,相同体积的物质,它们的物质的量必相等
B. 任何条件下,等物质的量的乙烯和CO中所含分子数必相等
C. 1 L CO一定比1 L O2的质量小
D. 等体积等物质的量浓度的强酸中所含的H+数一定相等
4. 用NA表示阿伏加德罗常数。下列叙述中正确的中 ( )
A. 0.1mol/L稀硫酸100mL中含有硫酸根离子个数为0.1NA
B. 1mol CH3+ 中含有电子数为10NA
C. 2.4 g金属镁与足量的盐酸反应,转移电子数为2NA
D. 12.4 g白磷中含有磷0.4NA原子,且含有0.6NA个P─P键
3. 最近医学界通过放射性14C标记的C60,发现一种C60的羧酸衍生物在特定条件下可通过DNA杀死细胞,从而抑制艾滋病(AIDS)。下列有关14C的叙述中正确的是( ) A. 与C60中普通碳原子的化学性质不同 B.与12C互为同位素
C. 是C60的同素异形体 D.与14N含的中子数相同
2. 若发现位于元素周期表第七横行、第十七纵行的元素的一种原子,该原子的质量数为280,则该原子核内的中子数为( ) A. 163 B.164 C. 165 D.166
1. 人体内的O2- 离子对健康有害,能使人过早衰老,这是因为O2-离子在人体内释放出氧化性极强的活性氧的缘故,医学界试图用对人体无害的亚硒酸钠消除人体内的活性氧,这是利用了亚硒酸钠的 ( ) A.催化性 B.氧化性 C. 还原性 D.既有氧化性又有还原性
26、(12分) 一定温度下,碳与水蒸气在容积不变的密闭容器中发生反应并建立化学平衡:
C(s) + H2O(g)  CO(g) + H2(g); △H>0
CO(g) + H2(g); △H>0
(1)平衡混合气体的平均相对分子质量M1的取值范围为 < Ml < ;
(2)将平衡混合气体升高温度,混合气体平均相对分子质量 (填“增大”、“减小”或“不变”,下同),密度将 ;
(3)若使用等物质的量CO和H2从逆反应方向在相同条件下建立平衡,则混合气体的平均相对分子质量M2的取值范围 < M2 < ;若使用不同物质的量的CO 和H2从逆反应方向在相同条件下建立平衡,则平衡混合气体的平均相对分子质量 M3的取值范围
< M3 < 。
(4)若起始投料: l mol C(s)和1mol H2O(g)。在相同条件下反应达平衡,混合气体平均相对分子质量为M,下列哪组投料在相同条件下建立平衡后混合气体的平均相对分子质量不可能为M的是 。
A.C(s):2mol,H2O(g):lmol
B.CO(g):1mol,H2(g):1mol
C.C(s):0.5mol,H2O(g)0.4mol,CO(g):0.6mol,H2(g):0.6mol
D.C(s):0.9mol,H2O(g):0.9mol,CO(g)0.1mol
(5)若在一定温度下,在一个容积可变的密闭容器中同时投入C(s)、H2O(g)、CO(g)、H2(g),达到平衡时混合气体的平均相对分子质量 M0。若给平衡体系加压,则混合气体的平均相对分子质量M的变化情况为(请填写条件和结论)
。
25、(6分)某天然碱的组成为xNa2CO3•yNaHCO3•zH2O,将称取的4.56g样品于300℃加热分解至完全(300℃时Na2CO3不分解),得到残留固体3.71g,分解产生的气体通入足量饱和的澄清石灰水中,全部吸收后可得到0.500g沉淀。请计算:
(1)该样品中结晶水的质量分数。
(2)通过计算确定该天然碱的化学式。
24.(6分)目前世界上比较先进的电解制碱术是离子交换膜法。试回答下列问题:
(1)电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有泥沙、Ca2+、Mg2+、Fe3+、SO42-杂质,不符合电解要求,因此必须经过精制。
除去SO42-可用钡试剂,该钡试剂可以是 。(选填a、b、c)
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(2)现有200mL食盐水,其中含有少量的NaOH,该溶液的pH等于10,用石墨电极电解,当阴极产生的气体体积为0.224L(标准状况)时停止电解。
阳极的电极反应式为 。
电解后溶液的pH约为(忽略溶液的体积变化) 。
23.(12分)右图是中学化学中常见物质之间的相互转化关系。其中,X是气体单质,Y是液体化合物,Z是常见的碱且焰色反应为黄色;W、L是固体单质,K、I中含有相同的元素;反应①是高温下进行的工业上制取H的第一步反应。请按要求填空:
(1)G、H的化学式分别为
G 、 H ,Y、Z的电子式分别为
Y 、Z ;
(2)写出下列反应的化学方程式:
① ;
④ ;
⑨ ;
(3)反应⑩中生成 1molL时,转移的电子数为 。
22、(12分)2005年10月12日9时,我国在酒泉卫星发射中心成功的发射了“神舟”六号载人飞船。将两名航天员同时送上太空,并于10月17日凌晨成功返回,为我国的航天事业写下了新的篇章。 ⑴火箭升空时,由于与大气层的剧烈摩擦,产生高温。为了防止火箭温度过高,在火箭表面涂上一种特殊的涂料,该涂料的性质最可能的是________; A、在高温下不融化 B、在高温下可分解气化 C、在常温下就分解气化 D、该涂料不可能发生分解 ⑵ 火箭升空需要高能的燃料,经常是用N2O4和N2H4作为燃料,其反应的方程式是: N2O4 + N2H4 → N2 + H2O 。请配平该反应方程式: ----N2O4 + ----N2H4 → ----N2 + ----H2O 该反应中被氧化的原子与被还原的原子物质的量之比是 。 这个反应应用于火箭推进器,除释放大量的热和快速产生大量气体外,还有一个很大的优点是 _______________________________________________。
(3)右图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,
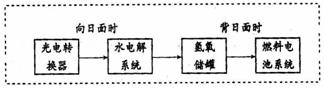 水电解系统中的阳极反应为:
水电解系统中的阳极反应为:
,
燃料电池放电时的负极反应:
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com