
题目列表(包括答案和解析)
5、设NA表示阿伏加德罗常数,下列叙述正确的是
A.标准状况下,11.2L CCl 4所含的原子总数等于2.5NA
B.常温常压下,12g 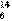 C中碳原子数小于 NA
C中碳原子数小于 NA
C.常温常压下,11.2LO2所含有氧原子数大于NA
D、1L 0.1mol/L氨水中含有0.1NA个NH 4+
4、加拿大阿尔贡天文台在星际空间发现了HC9N链状分子,其结构式为:
HC≡C-C≡C-C≡C-C≡C-C≡N,这是人类迄今发现的最重星际有机分子,有关该分子的说法不正确的是
A、该物质属于不饱和烃 B、该分子中所有原子处在一条直线上
C、该分子在一定条件下可发生加成反应 D、该分子碳、氮原子均满足八电子结构
3、最近有人用一种称为“超酸”的化合物H(CB11H6Cl6) 和C60反应,使C60获得一个质子,得到一种新型离子化合物[HC60]+[CB11H6Cl6]-。这个反应看起来很陌生,但反应类型上却可以跟下列一个化学反应相似,你认为该反应是
A、Mg +2HCl = MgCl2 + H2↑ B、NaOH + HCl = NaCl + H2O
C、NH3 +
HCl = NH4Cl D、H2O +CH3COOH  H3O+ +CH3COO
-
H3O+ +CH3COO
-
2、生物冶金技术越来越受到科学家的重视,这项技术的关键之一是寻找 一些特殊的酶。下列有关叙述错误的
 是
是
A、酶是一种蛋白质 B、酶只有在强酸性或强碱性条件下才能发挥作用
C、酶的催化作用具有高效性、选择性和专一性
D.发展生物冶金技术有利于节约能源和保护环境
1、重庆市天原化工厂今年4月16日发生特大氯气泄漏和三氯化氮爆炸事故,造成多人死亡和失踪。已知三氯化氮分子结构与氨相似,下列有关说法不正确的是
A、消除储气罐上空泄漏出的高浓度氯气,可喷洒碱液
B、发生氯气泄漏时,附近人员可用浸有碳酸钠溶液的毛巾捂住鼻孔进行自我保护
C、氯气能腐蚀金属及非金属材料,这种腐蚀主要属于电化腐蚀
D、三氯化氮分子是极性分子
20.甲、乙、丙、丁四种单质在点燃条件下反应生成X、Y、Z、W四种
化合物,转化关系如右图所示。又已知:①甲、乙、丙均为前三周期元
素的单质,常温下均为气体,丁是日常生活中的一种常见金属;②常温
下,X是无色液体,Y是黑色固体;③丙在乙中燃烧发出苍白色的火焰,
丁在乙中燃烧生成棕黄色的烟,W的水溶液呈黄色。请填空:
⑴丁在甲和X同时存在的条件下,可以被腐蚀,写出电极反应式:负极_________________________,正极__________________________;⑵将少量的W饱和溶液滴入到沸腾的X中,再插入连接有直流电源的两石墨电极,能看到___________________________________________________________(现象);⑶将Y看成碱性氧化物,Y与Z的溶液反应的离子方程式是:_________________________________;⑷若一定条件下丁分别与X、Z发生反应生成等物质的量的气体,则消耗丁的物质的量之比为_______。
19. 根据下列10种物质的化学式与序号填空:
①O2 ②Ne ③NH4Cl ④K2O2 ⑤HF ⑥CCl4 ⑦Cu ⑧NaF ⑨BF3 ⑩SiO2
⑴由非极性键形成的非极性分子是_____________;⑵由极性键形成的非极性分子是_____________;⑶由极性键形成的极性分子是_________________;⑷只由离子键形成的晶体是_________________;
⑸既有离子键又有非极性键的是_______________;⑹既有离子键又有极性键的是_______________;⑺仅以分子间作用力结合而成的晶体是_________;⑻仅以共价键相结合的晶体是_______________;
⑼分子中的原子未达到2个或8个电子稳定结构的是________;⑽在固态时也能导电的是_________。
18. 由FeCl3固体配制250mL0.1mol/L FeCl3溶液,导致所配溶液物质的量浓度偏低的是( )
①把FeCl3放在纸上用天平(准确)称取所需物质质量后,倒入烧杯中溶解(发现纸上有红褐色斑点);
②把用干净烧杯准确称量的FeCl3先加入少量盐酸中溶解后,再加水稀释;
③在转移刚溶解稀释的FeCl3溶液时发现容量瓶中有少量水存在;
④烧杯和玻璃棒分别用30mL水洗涤3次,每次洗涤液均倒入容量瓶,并摇匀;
⑤在称量过程中,FeCl3固体已部分潮解,且固体表面已形成了少许溶液;
A. ①②③ B. ①⑤ C. ②④⑤ D. ①②③④⑤
17. 将0.2molMnO2和50mL12.0mol/L盐酸混合缓缓加热(HCl无损失),反应完全后余下的溶液中加
入足量的AgNO3溶液,下列判断生成AgCl沉淀的物质的量正确的是( )
A.等于0.30mol B. 大于0.30mol C. 大于0.30mol,小于0.6mol D.以上结论都不正确
16. 有一未知浓度的硫酸溶液25mL,在加入0.5mol/L的Ba(NO3)2溶液25.0mL后,改加NaOH溶液,结果用去1.0mol/LNaOH溶液 50mL恰好完全中和,则硫酸的物质的量浓度为( ) A.0.5mol/L B.1.0mol/L C.1.5mol/L D.2.0mol/L
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com