
题目列表(包括答案和解析)
9.短周期元素A、B不属于同主族,形成的化合物的化学式为AB,若A的原子序数为n,则B的原子序数不可能为
A.n+1 B.n+2 C.n+3 D.n+4
8.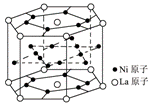 氢气是重要而洁净的能源,要利用氢气作能源,必须安全有效地储存氢气。有报道称某种合金材料有较大的储氢容量,其晶体结构的最小单元如右图所示。则这种合金的化学式为
氢气是重要而洁净的能源,要利用氢气作能源,必须安全有效地储存氢气。有报道称某种合金材料有较大的储氢容量,其晶体结构的最小单元如右图所示。则这种合金的化学式为
A.LaNi6 B.LaNi3 C.LaNi4 D.LaNi5
7.20℃时,将某硝酸钾溶液恒温蒸发水分,第一次蒸发掉10g水,冷却到原温度析出0g晶体;第二次蒸发掉10g水,冷却到原温析出3g晶体,第三次再蒸发掉10g水,冷却到原温度析出晶体应
A.等于3g B.大于或等于3g C.不等于3g D.小于或等于3g
6.将xmolAl2O3和ymolCuO混合后,全部溶于VL过量的稀硫酸中,然后向溶液中逐渐加入0.5mol/L的NaOH溶液,当加入aL时,生成的沉淀最多,则原稀H2SO4的物质的量浓度为
A (a/4V)mol/L B [(3Y+X)/V]mol/L C (a/2V)mol/L D 无法计算
5.通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可以估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
|
化学键 |
Si-O |
Si-Cl |
H-H |
H-Cl |
Si-Si |
Si-C |
|
键能 / kJ·mol-1 |
460 |
360 |
436 |
431 |
176 |
347 |
下列叙述正确的是
A.由于Si-C的键能大于Si-Si的键能,所以SiC的熔点高于晶体硅的熔点
B.由于Si-O的键能大于Si-Cl的键能,所以SiO2的熔点高于晶体SiCl4的熔点
C.SiCl4(g)+2H2(g) Si(s)+4HCl(g)的反应热计算式为:△H=(4×360kJ·mol-1+2×436kJ·mol-1 )-(4×176kJ·mol-1+4×431kJ·mol-1 )
Si(s)+4HCl(g)的反应热计算式为:△H=(4×360kJ·mol-1+2×436kJ·mol-1 )-(4×176kJ·mol-1+4×431kJ·mol-1 )
D.SiCl4(g)+2H2(g) Si(s)+4HCl(g)的反应热计算式为:△H=(4×360kJ·mol-1+2×436kJ·mol-1 )-(4×176kJ·mol-1-4×431kJ·mol-1 )
Si(s)+4HCl(g)的反应热计算式为:△H=(4×360kJ·mol-1+2×436kJ·mol-1 )-(4×176kJ·mol-1-4×431kJ·mol-1 )
4.下列条件下,两瓶气体所含原子数一定相等的是
A.同质量、不同密度的N2和CO
B.同温度、同体积的H2和N2
C.同体积、同密度的C2H4、C3H6
D.同压强、同体积的N2O和CO2
3.100g质量分数为63%的浓硝酸溶液中含氧原子的物质的量约为
A.1mol B. 3mol C.5.06mol D.6.02mol
2.“酸碱质子理论”认为凡是能够给出质子(H+)的分子或离子都是酸,凡是能够接受质子的分子或离子都是碱,物质酸性(碱性)的强弱取决于分子或离子给出(接受)质子能力的大小。按照“酸碱质子理论”,下列说法正确的是
A.HCO3-既是酸又是碱,NH3既不是酸又不是碱
B.ClO-+H2O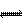 HClO+OH-不是酸碱反应
C.2Na+2H2O=2NaOH+H2↑是酸碱反应
D.碱性强弱顺序:C2H5O->OH->C6H5O-
HClO+OH-不是酸碱反应
C.2Na+2H2O=2NaOH+H2↑是酸碱反应
D.碱性强弱顺序:C2H5O->OH->C6H5O-
1.将一定量的金属钾放入236g t℃的水中,得到t℃的KOH饱和溶液312g,则t℃时,KOH的溶解度为 A.112g B.56g C.28g D.78g
9、已知Fe2O3在高炉中有下列反应:Fe2O3+CO 2FeO+CO2
2FeO+CO2
反应形成的固体混合物(Fe2O3、FeO)中,元素铁和氧的质量比用m(Fe):m(O)表示。
(1)上述固体混合物中,m(Fe):m(O)不可能是_________(选填a、b、c多选扣分)
A、21:9 B、21:7.5 C、21:6
(2)若m(Fe):m(O)=21:8,计算Fe2O3被CO还原的质量分数。
(3)设Fe2O3被CO还原的质量分数为A%,则A和混合物中m(Fe):m(O)的关系式为[用含m(Fe)、m(O)的代数式表示]。A%=___________。
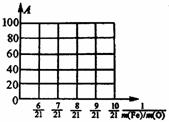
请在上图中画出表示A和m(Fe)/m(O)关系的图形。
(4)如果Fe2O3和CO的反应分两步进行:
3Fe2O3+CO 2Fe3O4+CO2
2Fe3O4+CO2
Fe3O4+CO2 3FeO+CO2
3FeO+CO2
试分析反应形成的固体混合物可能的组成及相应的m(Fe):m(O)[令m(Fe):m(O)=21:a,写出a的取值范围]。将结果填入下表:
|
混合物组成(用化学式表示) |
a的取值范围 |
|
|
|
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com