
题目列表(包括答案和解析)
3.(★★★★)将例题中的“23.4 g NaCl和40.4 g KNO3”改为“0.120 mol KCl和0.110 mol NaNO3”,其他不变,求m高温和m低温。
2.(★★★)将例题中的“40.4 g KNO3”改为“29.8 g KCl”,其他不变,试求m高温和m低温。
1.(★★★)取100 g H2O,配成10℃饱和KCl溶液,又取50 g 水,加入35.4 g NaNO3,配成10℃ NaNO3溶液。将以上两溶液混合后,10℃时有 种晶体析出,质量是______g,该晶体的化学式为 ,析出该晶体的原因是 (溶解度见例题)。
39.1 g-35.7 g)×(70.0 g-50.0 g)÷100 g=0.68 g
则:m低温=0.68 g+36.2 g=36.9 g
(2)两种原始溶液中,各种盐的物质的量都相等。
n(NaCl)=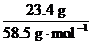 =n(KNO3)=
=n(KNO3)=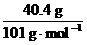 =n(NaNO3)
=n(NaNO3)
=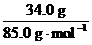 =n(KCl)=
=n(KCl)=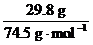 =0.400 mol。
=0.400 mol。
因而溶解后得到的两种溶液中四种离子浓度完全相同,根据溶解度数据可知,100℃时蒸发后得到的是NaCl晶体,冷却后得到的是KNO3晶体,但也含有少量的NaCl。所以第(2)小题不必再计算,便知:
m′高温=m高温=15.6 g m′低温=m低温=36.9 g
答案:(1)15.6 g 36.9 g (2)15.6 g 36.9 g
●锦囊妙计
多离子溶液中的任何一种阳离子与任何一种阴离子相结合都可构成为溶液的一种溶质,若忽略同离子效应和盐效应(即假定盐类共存时不影响各自的溶解度),当溶液中各离子浓度相等时,不论蒸发还是降温,溶解度最小的溶质首先析出,且析出盐的阳离子(或阴离子)与溶液中的其他阴离子(或其他阳离子)不会结晶析出,但与析出盐晶体中阴、阳离子无关的其他阴、阳离子所形成的溶质有析出的可能。
若溶液中各离子浓度不等,则有析出多种晶体的可能。若SA>SB>SC>SD,则晶体析出的先后顺序为:D、C、B,一般不会析出A。
●歼灭难点训练
40.4 g-20.9 g×(70.0g-50.0 g)÷100 g
=40.4 g-4.18 g
=36.2 g
析出NaCl晶体的质量为:
14.一种新型熔融盐燃料电池具有高发电效率而倍受重视。现有Li2CO3和Na2CO3的熔融盐混合物作电解质,一极通CO气体,另一极能O2和CO2的混合气体,制作650℃时工作的燃料电池,其电池总反应是2CO+O2 2CO2。则下列说法中正确的是
A.负极电极反应是:O2+2CO2+4e-=2CO32-
 B.通CO的一极是电池的正极
B.通CO的一极是电池的正极
C.熔融盐中CO32-的物质的量在工作时保持不变
D.正极发生氧化反
13.室温时,将xmlPH=a的稀氢氧化钠溶液与ymlPH= b的稀盐酸充分反应。下列关于反应后溶液PH的判断,正确的是
A.若x=y,且a+b=14,则PH>7 B.若10x=y,且a+b=13,则PH=7
C.若ax=by,且a+b=13,则PH=7 D.若x=10y,且a+b=14,则PH>7
12.室温下,等体积的下列各组酸和碱的溶液混合后,溶液PH<7的是
①PH之和为14的硝酸和氢氧化钾溶液
②PH之和为15的盐酸和氨水溶液
③PH之和为14的醋酸和苛性钠溶液
④PH之和为13的硫酸和氢氧化钡溶液
A.② B.①② C.②③ D.③④
11.一定温度下,反应2SO2+O2
 2SO3达到平衡时,n(SO2):n(O2):n(SO3)= 2:3:4 。缩小体积,反应再次达到平衡时,n(O2)=0.8mol、n(SO3)=1.4mol,此时SO2的物质的量应是
2SO3达到平衡时,n(SO2):n(O2):n(SO3)= 2:3:4 。缩小体积,反应再次达到平衡时,n(O2)=0.8mol、n(SO3)=1.4mol,此时SO2的物质的量应是
A.0.4mol B.0.6mol C.0.8mol D.1.2mol
10.铊(Tl)是某超导材料的组成元素之一,与铝同族,位于第6周期。Tl3+与Ag在酸性介质中发生反应:Tl3+ + 2Ag = Tl+ + 2Ag+ 。下列推断正确的是 A、Tl+的最外层有1个电子 B、Tl3+的氧化性比Al3+弱 C、Tl 能形成+3价和+1价的化合物 D、Tl+的还原性比Ag强
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com