
题目列表(包括答案和解析)
2、下列变化属于物理变化的是
A、硫酸镁溶液与Fe(OH)3溶胶混合 B、石墨转变为金刚石
C、.稀硫酸溶液导电 D、任何放热反应在常温下一定能发生反应
1.科学家在研究和探索中不断发现新的物质.据报道,1996年科学家在宇宙中发现H3分子,则H3和H2属于
A.同位素 B.同分异构体
C.同系物 D.氢的同素异形体
26、(10分)对一定量的KClO3加热使其部分分解,然后向反应后的混合溶液中加入足量的浓硫酸并加热发生如下反应:KClO3+5KCl+3H2SO4 3Cl2↑+3K2SO4+3H2O。假设原KClO3为m mo1,第一步反应KClO3分解率为a,两步反应生成的O2与Cl2总物质的量为n mol。
3Cl2↑+3K2SO4+3H2O。假设原KClO3为m mo1,第一步反应KClO3分解率为a,两步反应生成的O2与Cl2总物质的量为n mol。
(1)计算当氯元素全部转化为Cl2时的a值及n与m的函数关系式;
(2)讨论当a取不同值时,n与a、m的函数关系式及n的最大值。
25.(8分)现有一种碱金属的碳酸正盐和另一种碱金属的酸式碳酸盐组成的混合物试样,取试样0.506g加热至质量不再变化为止,将生成的气体用足量的澄清石灰水吸收,得到白色沉淀0.200g。将加热后残留的固体与足量稀硫酸充分反应,生成的气体充分干燥后通过足量的过氧化钠粉末,过氧化钠粉末的质量增加0.084g。试回答:
(1)混合物中酸式碳酸盐物质的量为 mol。
(2)加热后残留固体中两种碳酸盐的物质的量之和为 mol。
(3)通过计算和推断确定原混合物中两种盐的化学式。
24、(12分)已知A、B、C、D的组成元素都属于短周期,其中A、D为单质,B、C为化合物,它们之间的简单转化关系如图所示。请按要求写出有关反应式,是离子反应的只写离子方程式:
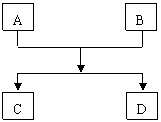
(1)若A、D的组成元素同主族:
①B是水:____________________________________________。
②B、C均为氧化物(反应有重要的工业价值):
____________________________________,工业价值是:_______________。
(2)若A、D的组成元素不同主族:
①B是水且水是还原剂:_________________________________。
②B是水且水是氧化剂(反应有重要的工业价值):
__________________________________,工业价值是:_________________。
③B、C均为氧化物:_______________________________________。
23、(9分)在某条件下,把4 mol A和4 mol B装入一个容积恒定的密闭容器中,发生如下反应:A(g)+4B(g)  2C(g)+D(g);△H<0 ,当反应达到平衡时,D为 n mol ,容器内的气体压强为P0。
2C(g)+D(g);△H<0 ,当反应达到平衡时,D为 n mol ,容器内的气体压强为P0。
(1)在上述完全相同的容器中维持温度不变,起始时加入1 mol C,为使平衡时D仍为n mol,
则还应加入A mol,B mol,D mol。
(2)达平衡时A的物质的量的取值范围是 ;
(3)达平衡时物质的量之比一定2∶1的是 ;
A、 A∶B B、B∶C C、C∶D D、以上均不可能
(4)若达平衡时,使D的物质的量大于n mol,所采取的措施是 。
A、向容器中再加入1mol A和1 mol B B、升高温度 C、加催化剂 D、降低温度
22、(6分)A、B、C、D、E是相邻三个短周期中的五种元素,它们的原子序数依次增大,B、C、D属同一周期,A 、E在周期表中处于同一纵行。己知:①除A外,各元素原子的内层均已填满电子,其中B的最外层有4个电子;②A与B,B与C都能生成气态非极性分子的化合物;③D与E生成离子化合物,其离子的电子层结构相同。回答:
(1)A为 元素,D为 元素。
(2)C元素在周期表中属 周期 族元素。
(3)用电子式表示D与E形成化合物的过程 ;
D与B形成的化合物的电子式 。
21、(9分)
(1)(5分)某一反应体系有反应物和生成物共五种物质:
O2、H2CrO4、Cr(OH)3、H2O、H2O2
已知该反应中H2O2只发生如下过程:H2O2→ O2
(1)该反应中的还原剂是 。
(2)该反应中,发生还原反应的过程是 → 。
(3)写出该反应的化学方程式,并标出电子转移的方向和数目
。
(4)如反应转移了0.3mol电子,则产生的气体在标准状况下体积为 。
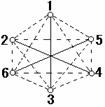 (2)(4分)SF6分子立体结构如图所示,其中1、2、3、4、5、6处的小圆圈表示F原子,且各相邻的F分子间的距离相等,S原子位于八面体的中心,则该分子是________(填极性或者非极性)分子;若氟有两种稳定的同位素,则由这两种同位素形成的SF6分子有______种。
(2)(4分)SF6分子立体结构如图所示,其中1、2、3、4、5、6处的小圆圈表示F原子,且各相邻的F分子间的距离相等,S原子位于八面体的中心,则该分子是________(填极性或者非极性)分子;若氟有两种稳定的同位素,则由这两种同位素形成的SF6分子有______种。
20、(10分)据2002年3月的《环球的时期》报道:意大利警方一举摧毁了四名摩洛哥人针对美国驻意大利大使馆的恐怖事件。警方从摩洛哥人的往宅中搜出了5 kg爆竹,2.5 kgK4[Fe (CN) 6]。据审讯,四名恐怖分子准备用爆竹做引爆剂,K4[Fe (CN) 6]在爆炸中可分解成一种剧毒的盐KCN。试根据要求回答下列问题:
⑴已知爆竹爆炸后,K4[Fe (CN) 6]会发生分解,除生成剧毒盐KCN外,还生成三种稳定单质。试写出该反应的化学方程式:___________________________________________。
⑵恐怖分子打算将产生的剧毒盐KCN用来污染水源,含CN-的污水危害极大。处理该污水时,可在催化剂TiO2作用下用NaClO将CN-氧化成CNO-,CNO-在酸性条件下继续被NaClO氧化生成N2和CO2,某环境部门用如图所示的装置进行实验,以证明该处理方法的有效并测定CN-被处理的百分率。将浓缩后含有CN-的废水与过量的NaClO溶液的混合液(其中含CN-为1.3g/L)200mL倒入甲中,塞上橡皮塞,一段时间后,打开活塞,使溶液全部放入乙中后关闭活塞。
①甲中反应的离子方程式为:_______________________________________,
乙中反应的离子方程式为:_________________________________________。
②乙中生成的气体除CO2、N2外还有HCl及副反应生成的Cl2等,上述实验是通过测定CO2的量来确定CN-的处理效果的。丙中加入的除杂试剂是__________________。
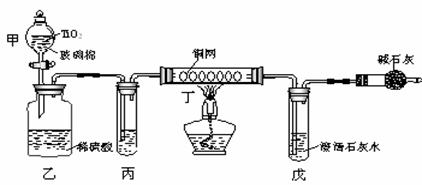
A.饱和NaCl溶液 B.饱和NaHCO3溶液
C.浓NaOH溶液 D.浓硫酸
丁在实验中的作用是_______________________________________。
戊中盛有足量的石灰水,若实验后戊中生成0.8g沉淀,则该实验中CN-被处理的百分率_______。
19、(1)(5分)下列实验操作或说法正确的是 。
A、用稀盐酸清洗做焰色反应的镍铬丝
B、用酒精萃取碘水中的碘
C、铜在氯气中加热燃烧可制得氯化亚铜
D、用碱石灰吸收氨气中的水蒸气
E、NaCl溶液中混有KBr,可以通入足量的氯气,再加热就可除去杂质
F、用食盐、浓硫酸、MnO2混和加热制Cl2
G、侯氏制碱法原理:向饱和食盐水中先通入足量的CO2再通入足量的NH3
H、为提高高锰酸钾溶液的氧化能力,用盐酸将KMnO4溶液酸化
(2) (7分)根据下图实验,填空和回答问题
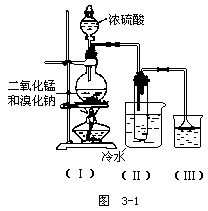
A.烧瓶中所发生的主要反应的化学方程式为:______
装置(Ⅱ)的烧杯中冷水的作用是:______
装置(Ⅲ)的烧杯中液体的作用是:______
B.进行此实验时,烧瓶内的橡皮塞最好用锡箔包住,用橡皮管连接的两玻璃管口要相互紧靠,这是因为______。
C.装置(Ⅲ)的烧杯中使用倒置漏斗可防止液体倒吸,试简述其理由______。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com