
题目列表(包括答案和解析)
18.下列离子方程式中正确的是
A.H2SO4与Ba(OH)2溶液反应:Ba2++2OH-+2H+十SO42-=BaSO4↓+2H2O
B.Ca(HCO3)2与过量Ca(OH)2溶液反应:Ca2++HCO3-+2OH-=CaCO3↓+ CO32-+2H2O
C.Na2CO3溶液中通入少量CO2: CO32-+ CO2+ H2O=2HCO3-
D.CH3COOH溶液与NaOH溶液反应: H++ OH-=H2O
17. 一个价电子构型为2S2 2P5 的元素,下列关于它的描述正确的是
A.原子序数为9 B.同周期元素种电负性最大
C.原子半径比O原子要大 D.第一电离能最大
16.向0.1mol/L CH3COOH溶液中加入CH3COONa晶体或加等体积水稀释时,都会引起 ( )
A.溶液的pH增大 B.CH3COOH的电离程度增大
C.溶液的导电能力减小 D.溶液的c (OH – )减小
15.2003年10月15日我国成功发射了第一艘载人航天飞船--“神州五号”。从此我国进入了航天大国和航天强国行列。发射“神五”时用肼(N2H4)作为火箭发动机的燃料,NO2为氧化剂,反应生成N2和水蒸气。已知:N2(g) + 2O2(g) = 2NO2(g);△H = + 67.7kJ/mol。 N2H4(g) + O2(g) = N2(g) + 2H2O(g);△H = – 534kJ/mol。下列关于肼和NO2反应的热化学方程式中,正确的是 ( )
A.2N2H4(g) + 2NO2(g) = 3N2(g) + 4H2O(l);△H = – 1135.7kJ/mol
B.2N2H4(g) + 2NO2(g) = 3N2(g) + 4H2O(g);△H = – 1000.3kJ/mol
C.N2H4(g) + NO2(g) = 3/2N2(g) + 2H2O(l);△H = – 1135.7kJ/mol
D.2N2H4(g) + 2NO2(g) = 3N2(g) + 4H2O(g);△H = – 1135.7kJ/mol。
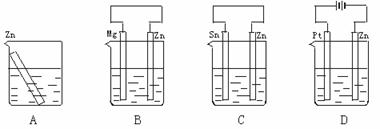
14.分别放置在图4-10所示装置(都盛有0.1 mol·L-1的H2SO4溶液)中的四个相同的纯锌片,腐蚀最慢的是
13.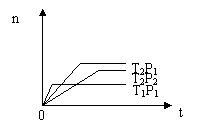 应2X(g)+Y(g)
应2X(g)+Y(g) 2Z(g);△H<0(正反应为放热反应)。在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量[n(Z)]与反应时间(t)的关系如图所示。则下列判断正确的是 ( )
2Z(g);△H<0(正反应为放热反应)。在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量[n(Z)]与反应时间(t)的关系如图所示。则下列判断正确的是 ( )
、 A.T1<T2,P1<P2
B.T1<T2,P1>P2
C.T1>T2,P1>P2
D.T1>T2,P1<P2
12.下列离子组能够在溶液中大量共存,加入NaOH溶液有沉淀生成,加入稀盐酸有气体放出的是 ( )
A.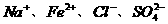 B.
B.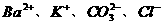
C.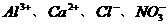 D.
D.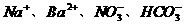
A、常温常压下,0.1mol Ne含有的电子数约为6.02×1023
B、标准状况下,11.2L SO3所含硫原子个数约为3.01×1023
C、由2H和18O所组成的水11g,其中所含的中子数为2.408×1024
D、1mol Cl2与足量水反应,转移的电子数为1.204×1024
11、7.下列指定微粒数目之比不是1:1的是
A.Na2O2晶体中的阴离子和阳离子
B.NaHCO3溶液中的钠离子和碳酸氢根离子
C.24 12Mg2+ 离子中的质子数和中子数 D.氯化钠溶液中的钠离子和氯离子
9.已知450℃时,反应H2(g)+I2(g) 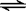 2HI(g)的K=50,由此推测在450℃时,反应2HI(g)
2HI(g)的K=50,由此推测在450℃时,反应2HI(g) 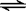 H2(g)+I2(g)的化学平衡常数为
H2(g)+I2(g)的化学平衡常数为
A.50 B.0.02 C.100 D.无法确定
8.一定条件下反应N2(g)+3H2(g)
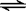 2NH3(g )在10L的密闭容器中进行,测得2min内,N2的物质的量由20mol减小到8mol,则2min内N2的反应速率为
2NH3(g )在10L的密闭容器中进行,测得2min内,N2的物质的量由20mol减小到8mol,则2min内N2的反应速率为
A.1.2mol/(L·min) B.1mol/(L·min)
C.0.6mol/(L·min) D.0.4mol/(L·min)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com