
题目列表(包括答案和解析)
4.设阿伏加德常数为NA。则下列说法正确的是
A 常温常压下,11.2LCO2中含有的氧原子数为NA
B
标准状况下,1.8g D2O(D为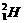 )中含有的中子数为NA
)中含有的中子数为NA
C 常温下,2.4g镁与足量的盐酸反应,失去的电子数为0.2NA
D 常温下,1L 0.1mol/L Na2CO3溶液中含CO32-数为0.1NA
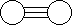
3.已知三角锥形分子E和直线形分子G反应,生成两种直线形分子L和M(组成E、G、L、M分子的元素原子序数均小于10)如下图,则下列判断错误的是
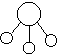 +
+
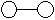
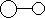 +
+
E G L M
A G是最活泼的非金属单质 B M化学性质很活泼
C E能使红色石蕊试液变蓝色 D L分子中含有极性键
2.有关化学用语正确的是
A. 乙烯的最简式(实验式)C2H4 B. 乙醇的结构简式C2H6O
C. 四氯化碳的电子式
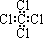 D. 臭氧的分子式O3
D. 臭氧的分子式O3
1.下列化学名词正确的是
A.明凡 B. 苛性钠 C. 乙酸乙脂 D. 三溴笨酚
26.(10分)加热100g Na2CO3和NaHCO3的混合物至质量不再变化,剩余固体的质量为87.6g,将产生的CO2和水蒸气的混合气体与足量的Na2O2充分反应后,固体质量增加了6g。计算:
(1)原混合物中Na2CO3的质量分数;
(2)混合气体与足量的Na2O2充分反应后,生成氧气的物质的量;
(3)若将a mol NaHCO3和b mol Na2O2混合,在密闭容器中加热至300℃使其充分反应,排出气体物质,最后容器中所得残留物是Na2CO3时,请推出a和b的关系式。
25.(8分) 将一定量的NaOH和NaHCO3的混合物放在密闭的容器中加热,充分反应后生成CO2的体积为V1(V1≠0)。将反应后的固体残渣Y与过量的稀盐酸反应,又生成V2体积的CO2(V1、V2)均为标准状况的体积)。试回答下列
(1)固体残渣成分是 ;
(2)若2 V1=V2,则原混合中NaOH和NaHCO3的物质的量之比为 。
23.(10分)某无色溶液,其中有可能存在的离子如下:Na+、Ag+、Fe3+、Ba2+、Al3+、
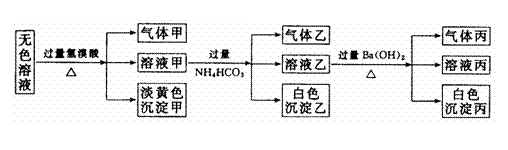 AlO2-、S2-、SO
AlO2-、S2-、SO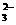 、SO
、SO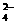 ,现取该溶液进行有关实验,实验结如下:
,现取该溶液进行有关实验,实验结如下:
(1)沉淀甲是 (填化学式), 生成沉淀甲的离子方程式为
(2)沉淀乙是 (填化学式),由溶液甲生成沉淀乙的离子方程式为
(3)沉淀丙可能是 (填化学式)。
(4)气体甲的成分有哪几种可能,答:① ② ③
(有多少种就填多少种,可不填满。)
(5)综合上述信息,可以肯定存在的离子有
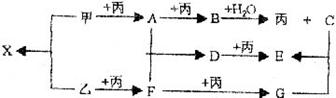 24(8分)已知甲、乙、丙常见单质,A、B、C、D、E、F、G、X均为常见的化合物;B和X的摩尔质量相同,E的式量比D的式量大16,在一定条件下,各物质的相互转化关系如下图所示:
24(8分)已知甲、乙、丙常见单质,A、B、C、D、E、F、G、X均为常见的化合物;B和X的摩尔质量相同,E的式量比D的式量大16,在一定条件下,各物质的相互转化关系如下图所示:
(1)写出X的电子式和G的化学式
X G
(2)完成下列有关变化的离子方程式
X的水溶液呈碱性:
过量的F与C溶液反应:
22.(10分)过氧化氢(H2O2)可作为采矿业废液消毒液,如消除采矿液中的氰化物(含CN-,其中N为-3价),反应方程式(已配平)如下:KCN+ H2O2 + H2O === A+ NH3↑。请回答:
⑴生成物A的化学式是________;
⑵该反应___________(填“是”或“不是”)属于氧化还原反应;若是,则被还原的元素是________(填物质的化学式)中的______;反应中被氧化的元素为______________;若不是,其理由是___________________________________________________。
⑶在标准状况下有0.448L氨气生成,则转移的电子为__________mol。
21.(8分)氢氧化钠又称 、 或 ,它极易溶于水,且 ,在空气中易吸收水蒸气,而发生 ,因此,氢氧化钠可作为一些气体的 ,对它必须 保存,且瓶塞要用 。
 19某实验小组对中学课本中可生成H2的反应进行了研究,总结出四个可以生成H2的反应①Zn和盐酸
②钠和水 ③铝和氢氧化钠溶液 ④钠和无水乙醇.为点燃上述四个反应生成的氢气,他们设计了如图所示的装置:
19某实验小组对中学课本中可生成H2的反应进行了研究,总结出四个可以生成H2的反应①Zn和盐酸
②钠和水 ③铝和氢氧化钠溶液 ④钠和无水乙醇.为点燃上述四个反应生成的氢气,他们设计了如图所示的装置:
请回答下列问题:
⑴写出钠和水反应的化学方程式:
⑵在点燃之前必须先进行
方法是
⑶实验小组在点燃用上述装置制得的H2时①③④实验获得了成功.②却失败了.他们分析认为失败的原因是钠与水的太快,钠的用量太少.于是他们准备增加钠的用量,可教师说太危险.你认为产生危险的原因是
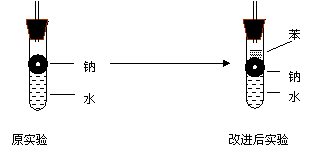 ⑷实验小组查阅钠 苯 水的密度分别是0.97g/ml 0.88 g/ml 1.00
g/ml并据此对实验进行了改进
⑷实验小组查阅钠 苯 水的密度分别是0.97g/ml 0.88 g/ml 1.00
g/ml并据此对实验进行了改进
反应速率在改进后的实验中,H2和生成速率减慢.原因是
20.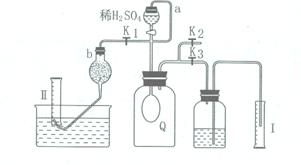 为测定可能部分变质的过氧化钠(含碳酸钠)的纯度,设计如右图所示的实验,其中Q为一开始无气体的气囊。取一定量的样品放于Q中,按图安装好实验装置,打开分液漏斗的活塞,将稀硫酸滴入气囊中充分反应(液体体积忽略不计)。
为测定可能部分变质的过氧化钠(含碳酸钠)的纯度,设计如右图所示的实验,其中Q为一开始无气体的气囊。取一定量的样品放于Q中,按图安装好实验装置,打开分液漏斗的活塞,将稀硫酸滴入气囊中充分反应(液体体积忽略不计)。
⑴ Q内发生反应生成___________种气体。
⑵ 为测出反应时生成气体的总体积,滴稀硫酸前必须关闭________(填“K1” 、“K2” 或“K3”,下同),打开________________。
⑶ 当上述反应停止,将K1 、K2、K3处于关闭状态,然后先打开K2,再缓缓打开K1。采取适当措施保证气囊内气体全部排尽且不使液体溢出。
上图b中装的试剂是________________________。
要缓慢打开K1的理由是____________________________________________________。
⑷ 实验结束时,量筒Ⅰ中有xmL水,量筒Ⅱ中收集到ymL气体(以上实验数据在同温同压下测定。),则原样品中过氧化钠的纯度是_________________(用含x、y的代数式表示)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com