
题目列表(包括答案和解析)
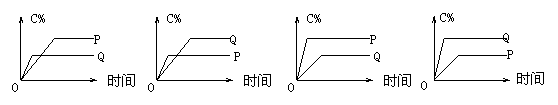
4、在A(g)+B(g)=C(g)+D(g)的反应体系中,C的百分含量和时间的关系如图所示,若反应分别在400℃和100℃下进行,所得曲线分别为Q与P,则正反应是放热反应的图为
3、NA表示阿伏加德罗常数,以下说法正确的是 ( )
A、31g白磷含有P-P键的总数为6 NA
B、1.6gNH2-离子含有电子总数NA
C、1L 1mol·L-1 FeCl3溶液中含有Fe3+的数目为NA
D、标准状况下,22.4L的HC1气体溶于lL水中得到O.1mol/L的盐酸溶液
2、在下列化学反应中,既有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键形成的是 ( )
|
C、Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑D、NH4Cl+NaOH = NaCl+H2O+NH3↑
1、下列变化一定不包含化学变化的是: ( )
A、皂化反应后,加入食盐,使肥皂凝聚B、钢铁在潮湿的空气中生锈
C、纯碱在空气中风化 D、无水硫酸铜溶于水溶液呈蓝色
109.(05广东,26)某研究性学习小组欲用化学方法测量一个不规则容器的体积。把35.1g NaCl放入500 mL烧杯中,加入150 mL蒸馏水。待NaCl完全溶解后,将溶液全部转移到容器中,用蒸馏水稀释至完全充满容器。从中取出溶液100mL,该溶液恰好与20 mL 0.100 mol·L-1AgNO3溶液完全反应。试计算该容器的体积。
答案:V容器 =30L
108.(05上海,30)过氧化钙是一种安全无毒的物质,带有数量不等的结晶水,通常还含有部分CaO。
(1)称取0.542g过氧化钙样品,灼热时发生如下反应:2CaO2·XH2O  2CaO + O2↑ + 2XH2O,得到的O2在标准状况下体积为67.2mL,该样品中CaO2的物质的量为 。
2CaO + O2↑ + 2XH2O,得到的O2在标准状况下体积为67.2mL,该样品中CaO2的物质的量为 。
(2)另取同一样品0.542g,溶于适量的稀盐酸中,然后加入足量的Na2CO3溶液,将溶液中Ca2+全部转化为CaCO3沉淀,得到干燥的CaCO3 0.70g。
① 试计算样品中CaO的质量。
② 试计算样品中CaO2·XH2O的X值。
答案:(1)0.006mol (2)① m(CaO) = 0.056g ② X = 1/2
107.(04上海,30)氢氧化钡是一种使用广泛的化学试剂。某课外小组通过下列实验测定某试样中Ba(OH)2·nH2O的含量。
(1)称取3.50 g试样溶于蒸馏水配成100 mL溶液,从中取出10.0 mL溶液于锥形瓶中,加2滴指示剂,用0.100 mol / L HCl标准溶液滴定至终点,共消耗标准液20.0 mL(杂质不与酸反应),求试样中氢氧化钡的物质的量。
(2)另取5.25 g试样加热至失去全部结晶水(杂质不分解),称得质量为3.09 g,求Ba(OH)2·nH2O中的n值。
(3)试样中Ba(OH)2·nH2O的质量分数为 。
答案:(1)0.01 mol (2)n=8 (3)ω[Ba(OH)2·nH2O]=0.90
106.(04全国,29)抗击“非典”期间,过氧乙酸( )是广为使用的消毒剂。它可由H2O2和冰醋酸反应制取,所以在过氧乙酸中常含有残留的H2O2。测定产品中过氧乙酸浓度c0。涉及下列反应:
① □MnO4+□H2O2+□H+===□Mn2++□O2十□H2O
② H2O2+2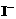 +2H===I2+2H2O
+2H===I2+2H2O
|
③
+2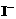 +2H+===CH3COOH+I2+H2O
+2H+===CH3COOH+I2+H2O
④ I2 + S2O32- =2I- + S4O62-
请回答以下问题:
(l)配平反应①的离子方程式(配平系数填人以下方框内):
□MnO4+□H2O2+□H+===□Mn2++□O2十□H2O
(2)用Na2S2O3标准溶液滴定I2时(反应④)选用的指示剂是___________________________。
(3)取b0
mL待测液,用硫酸使溶液酸化,再用浓度为a1 mol·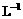 的KmnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为b1 mL(反应①,滴定过程中KmnO4不与过氧乙酸反应)。
的KmnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为b1 mL(反应①,滴定过程中KmnO4不与过氧乙酸反应)。
另取b0
mL待测液,加入过量的KI,并用硫酸使溶液酸化,此时过氧乙酸和残留的H2O2都能跟 KI反应生成
I2(反应②和③)。再用浓度为a2 mol·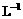 的Na2S2O3标准溶液滴定生成的I2,耗用Na2S2O3溶液体积为b2 mL。
的Na2S2O3标准溶液滴定生成的I2,耗用Na2S2O3溶液体积为b2 mL。
请根据上述实验数据计算过氧乙酸的浓度(用含a1、a2、b0、b1、b2的代数式表示)。c0= ___________。
(4)为计算待测液中过氧乙酸的浓度c0,加入的KI的质量已过量但没有准确称量,是否影响测定结果 _______________(填是或否)
答案:(1) 2 5 6
2 5 8 (2)淀粉溶液 (3) (4)否
(4)否
105.(04广东,26)孔雀石和石青是自然界存在的两种碳酸盐类铜矿,它们的化学组成可表示为:
xCuCO3•yCu(OH)2 (x、y为正整数且x≤2,y≤2)
(1)孔雀石和石青分别与过量盐酸反应时,孔雀石耗用的盐酸的物质的量与生成的CO2的物质的量之比为4:1;石青则为3:1。请推算它们的化学组成。孔雀石: 石青:
(2)现有孔雀石和石青混合样品,取两份等质量的样品,在一份中加入过量盐酸,生成CO2 3.36L(标准状况下);加热另一份样品使其完全分解,得到CuO 20g,试通过计算确定该混合物中孔雀石和石青的物质的量之比。
答案:(1)孔雀石的化学式为 CuCO3•Cu(OH)2 石青的化学式为 2CuCO3•Cu(OH)2
(2)孔雀石与石青物质的量之比为1:1
|
15.75-15) y=1.5 mol
n( Cu )=6-1.5 mol×2=3 mol
解析:从上述化学方程式可知,生成物为Cu、FeO、SO2。只须配平下面的化学方程式就能很好地解题。6CuFeS2+15O2=6Cu+6FeO+12SO2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com