
题目列表(包括答案和解析)
2.在同期表中,同一主族元素化学性质相似。目前已发现有些元素的化学性质和它在周期表中左上方或右下方的另一主族元素性质相似,这称为对角线规则。据此请回答:
(1)锂在空气中燃烧,除生成 外,也生成微量的 。
(2)铍的最高价氧化物对应的水化物的化学式是 ,属两性化合物,证明
这一结论的有关离子方程为 、 。
(3)若已知反应Be2C+4H2O=2Be(OH)2+CH4↑,则Al4C3遇强碱溶液反应的离子方程式为
。
(4)科学家证实,BeCl2属共价化合物,设计一个简单实验证明,其方法是
。用电子式表示BeCl2的形成过程: 。
1.“-OH”化学上称为羟基,上个世经60年代美国化学家鲍林提出一个经验规则:设含氧酸的化学式为HnROm,其中(m-n)为非羟基氧原子数。鲍林认为含氧酸的强弱与非羟基氧原子数(m-n)有如下关系:
|
m-n |
0 |
1 |
2 |
3 |
|
酸的强弱 |
弱 酸 |
中 强 |
强 |
很 强 |
|
实 例 |
HClO |
H3PO4 |
HNO3 |
HClO4 |
(1) 按此规则判断H3AsO4、H2CrO4、HMnO4酸性由强到弱的顺序为_________________________________________。
(2) H3PO3和H3AsO3的分子组成相似,但酸性强弱相差很大,已知H3PO3为中强酸,H3AsO3为弱酸。试推断有关酸的结构式H3PO3_____________ H3AsO3_____________。
8.亚硝酸钠NaNO2可用作水泥施工的抗冻剂。它易溶于水,有碱性,有氧化性,也有还原性。在酸性溶液中它能氧化碘离子、亚铁离子。它能将人体内血红蛋白里所含的亚铁离子氧化为三价铁离子使人中毒,在建筑工地上多次发生把亚硝酸钠误作食盐使用,导致民工中毒的事件。亚硝酸钠和酸反应产生亚硝酸,亚硝酸是不稳定的弱酸,它只存于冷的稀溶液中,易发生分解反应:3HNO3=2NO↑+HNO3+H2O。
从醋酸、氨水、纯碱、稀盐酸、碘化钾-淀粉溶液中选择适当的物质做试剂,用两种简单的化学实验方法来鉴别亚硝酸钠和氯化钠。
方法一:试剂是(只用一种试剂);现象: 。
方法二:实验步骤及实验现象是 。
7.某学生设计了一套验证物质化学性质的实验装置(如下图):请完成下列问题:
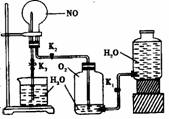 (1)该实验的目的是
。
(1)该实验的目的是
。
(2)该实验的原理是(用化学方程式表示)
。
(3)检查本装置气密性的最好方法是 。
(5)实验步骤:①按图连接好仪器装置;②打开活塞K1和
K2,主要现象为____________;③关闭活塞K1和K2,打开止水
夹K3,要使烧瓶内产生喷泉,可采用的方法是 。
5.某校化学兴趣小组的同学在进行研究性学习时,对“NO2能否支持燃烧”这个问题很感兴趣,他们决定自己动手设计实验进行探究。
(1)甲组同学设计的实验方案:向烧瓶中加入适量浓硝酸并加热,当烧瓶中有红棕色气体产生之后,将燃着的木条伸人烧瓶中,发现木条火焰熄灭。由此他们得出“NO2不能支持燃烧”的结论。
甲组同学所得的结论正确吗?请你说明理由:_____________________________ _________________________。
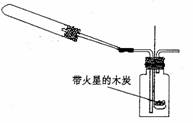 (2)乙组同学通过查阅资料得知,一些不活泼金属的硝酸盐受热时也能产生NO2气体,
(2)乙组同学通过查阅资料得知,一些不活泼金属的硝酸盐受热时也能产生NO2气体,
如:2Cu(NO3)2 2 CuO+4NO2↑,
2AgNO32Ag+2NO2↑+O2↑。他们根据此原理设计了
如右图所示的实验装置(加热、夹持仪器未画出),并分别用
Cu(NO3)2和AgNO3进行实验,实验中发现当红棕色气体进入
集气瓶后,带火星的木炭均能复燃,乙组同学由此得出“NO2能支持燃烧”的结论。
①老师认为上述两个实验中,有一个实验所得结论是不可靠的,你认为该实验中选用的反应物是__________,其结论不可靠的原因是_________________.
②运用该实验装置进行实验时,造成的不良后果是______________________________
_______________。
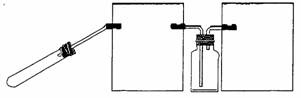 (3)丙组同学拟设计一个用较为纯净的NO2气体(无O2产生)来探究“NO2能否支持燃烧”的实验。
(3)丙组同学拟设计一个用较为纯净的NO2气体(无O2产生)来探究“NO2能否支持燃烧”的实验。
①丙组同学制取NO2的化学方程式是
_______________。
②右图是该组同学设计的制取并收集
NO2气体的实验装置,请在方框中将该装
置补充完整,并注明补充装置中所用试剂。
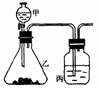 6.化学虽然是一门知识比较繁杂的学科,但有极强的规律性,要学好化学
6.化学虽然是一门知识比较繁杂的学科,但有极强的规律性,要学好化学
必须善于掌握这些规律,这样有利于我们对零散的知识理解和记忆。在我
们的课本或课堂中出现的几率最多的是右图的装置,它是由物质制备和检
验生成物性质两部分组成的,(暂不考虑除杂,尾气的吸收)。请你选用中
学化学常见试剂设计两个实验,将所用试剂名称、丙中现象及由此得出的
实验结论(可以是单一物质的性质,也可以是不同物质性质比较)填入下列空白处:
(1)[实验一]
所用试剂:甲___________、乙___________、丙___________;
丙中现象 ;
实验结论 。
(2)[实验二]:甲___________、乙___________、丙___________;
丙中现象 ;
实验结论 。
4.中学教材上有如下介绍:在氢氧化钠浓溶液中加入氧化钙,加热,制成的白色固体就是碱石灰。有两个实验小组的同学决定通过实验探究碱石灰的组成。
(1)第一小组设计方案的流程如下:
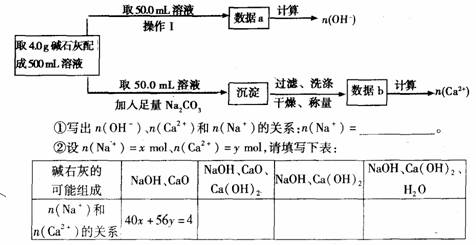
(2)第二小组同学查得如下资料:Ca(OH)2在250℃时不分解、NaOH在580℃时不分解。他们设计了如下方案并得出相关数据:取市售碱石灰4.0g,在2500C时加热至恒重,测得固体质量减少了0.6g,剩余固体在5800C时继续加热至恒重,固体质量又减少了0.7g。请经过计算确定该碱石灰各成分的质量分数。
3.某化学研究性学习小组在研究KClO3制取氧气实验时查得如下资料:
资料一:KClO3单独加热到3630C时熔融,在3800C时发生两个反应:
①4KClO3=3KClO4+KCl ②2KClO3=2KCl+3O2↑
加热至4000C以上时KClO4又发生分解,放出大量的O2。
资料二:若用MnO2作催化剂,则KClO3在2000C时就能迅速分解,但制得的氧气中有氯气的气味,生成的氯化钾又略带紫红色,反应过程如下:
③2KClO3+2MnO2=2KMnO4+Cl2↑+O2↑ ④2KMnO4=K2MnO4+MnO2+O2↑
⑤Cl2+K2MnO4=2KCl+MnO2+O2↑
资料三:部分物质的物理性质
|
物质 颜色的状态 |
密度/g·cm3 |
00C时溶解度/g |
1000C时溶解度/g |
|
KCl 无色晶体 |
1.98 |
27.6 |
56.7 |
|
KClO3 无色晶体 |
2.32 |
3.3 |
57 |
|
KClO4 无色晶体 |
2.52 |
0.75 |
21.8 |
(1)在KClO3与KClO4中,热稳定性较好的是___________。
(2)单独加热KClO3制取氧气时,试管口应稍向 (填“上”或“下”)倾斜,证明生成物中有KCl的方法是:_________________。假设资料一中只发生反应①,则证明有KClO4生成的实验方法是______________________________。
(3)若用MnO2作催化剂制取氧气时,反应③中氧化产物是______(填化学式),按该反应过程,若制取1.5molO2,总共有______mol电子发生转移。
(4)若用MnO2作催化剂加热KClO3时,两者质量比以MnO2占1/3为最好。若用占1/10的MnO2和KClO3共热时,开始放出氧气较慢,继续加热至一定温度时,放出氧气的速率会很快,其主要原因可能是___________________________。
2.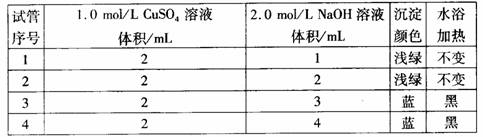 某实验小组的同学探究氢氧化铜的制法。实验记录为
某实验小组的同学探究氢氧化铜的制法。实验记录为
(1)同学们猜想3、4号试管中沉淀为Cu(OH)2, 1、2号试管中沉淀为Cu2(OH)2SO4。试写生成Cu2(OH)2SO4的离子方程式 。
 实验:
实验:
操作I名称__________,需要的玻璃仪器有________________,如何操作才能保证最后白色沉淀中SO42-来自绿色固体_____________。
12、AD 13、B 14、AD 15、B 16、CD 17、A 18、BD 19、AC
19、100℃时向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH=2,下列叙述不正确的是
A、此时水的离子积KW=1.0×10-14; B、水电离出的[H+]=1.0×10-10mol/L
C、水的电离度随温度升高而降低; D、C(H3O+)>C(SO42-)
请将答案填入下答题卡中:
姓名_____ 考号______成绩______
答案:1、B 2、C 3、D 4、B 5、C 6、B 7、D 8、C 9、A 10、A 11、CD
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com