
题目列表(包括答案和解析)
2.某有机化合物X(C12H13O6Br)遇FeCl3溶液显紫色,其结构简式如下
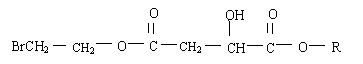
(1)X在足量的NaOH水溶液中加热反应得到A、B、C三种有机物,C中只有一种氢原子。则A、B、C的结构简式为:
A ,B ,C 。
(2)2003年11月《环球时报》美国特约记者文章:一种名为苹果醋(ACV)的浓缩饮料多年来风靡美国,苹果酸是这种饮料的主要酸性物质。室温下A用盐酸酸化即可得到苹果酸E。
①E的同分异构体很多,其中只含醇羟基、醛基和羧基三种官能团的稳定化合物只有两种,试写出其中一种同分异构体结构简式: 。
②两分子E通过分子间脱水可形成 种环状酯,试写出其中生成的六元环状酯的化学方程式: 。
(3)C经盐酸酸化可得F,试写出F与足量浓溴水反应的化学方程式:
。
1.
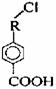 有机物A的相对分子质量为198.5,其结构简式如右(-R-代表某种烷基),已知在光照条件下,A分子中一个氢原子被氯原子取代时只得到一种产物,A在一定条件下还有如右图的反应关系:
有机物A的相对分子质量为198.5,其结构简式如右(-R-代表某种烷基),已知在光照条件下,A分子中一个氢原子被氯原子取代时只得到一种产物,A在一定条件下还有如右图的反应关系:
(1)烷基-R-对应的烷烃的名称为 ;烷基-R
-的同分异构体有______种。
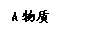 (2)B的结构简式
(2)B的结构简式
为 ;F的结构简式
为 。
(3)C→D的化学方程式为 ;反应类型为 。
(4)G显酸性,试求M(G)-M(B)= 。
5.铁在热的稀HNO3中反应,其主要还原产物为N2O,而在冷的稀HNO3中反应,其主要还原产物为NO,当溶液更稀时,其主要产物为NH4+,请分析图回答有关问题:
(1)假设在任一气体产生的曲线段内只有一种还原产物,试配平由b到c点时反应的化学方程式: Fe + HNO3 -- Fe(NO3)3 + + H2O
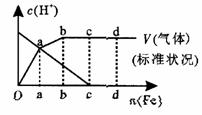 (2)判断从O点到点a时的还原产物,应为
。
(2)判断从O点到点a时的还原产物,应为
。
(3)a点到b点时产生还原产物为 。
(4)已知到达d点时反应完全结束,此时溶液中的主要阳离子为 。分析c点与 d点投入金属铁的物质的量之比 。
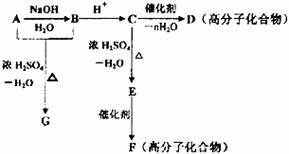
4.下图所涉及的物质均为中学化学中的常见物质,其中C、D、E为单质,其余为化合物。它们存在如下转化关系,反应中生成的水及次要产物均已略去。
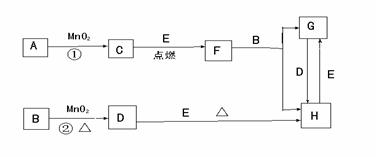
(1)写出化学式:B ,E 。
(2)指出MnO2在相关反应中的作用: 反应①中是 剂,反应②中是 剂。
(3)完成F与B 发生反应的化学方程式 。
(4)若反应①是在加热条件下进行,A是 ;反应①是在常温条件下进行,A是 。
若在上述两种条件下得到等量的C单质,反应中转移的电子数之比为 。
3.江苏省东临大海,利用海水等可制得多种化工产品。下图是以海水、贝壳等为原料制取几种化工产品的转化关系图,其中E是一种化肥,N是一种常见的金属单质。
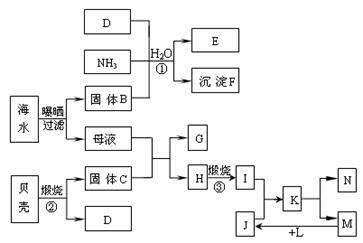
试填写下列空白:
⑴N的化学式为: ;
⑵写出反应①的化学方程式: ;
⑶由K溶液经如何处理才能制得N? 。
2. 下图表各物质之间的转化关系。已知:A、B、I都是XY2型化合物,且阳离子相同,A、B晶体中阴、阳离子个数比都是1∶1,但I晶体中阴、阳离子个数比是2∶1,I常用作干燥剂。
下图表各物质之间的转化关系。已知:A、B、I都是XY2型化合物,且阳离子相同,A、B晶体中阴、阳离子个数比都是1∶1,但I晶体中阴、阳离子个数比是2∶1,I常用作干燥剂。
请按要求填空:⑴G的电子式是_______________;
⑵反应⑥的化学方程式是__________________________________,反应⑤在空气中发生时的现象是________________________________,已知C的燃烧热是1300 kJ·mol-1,表示C的燃烧热的热化学方程式是________________________________________。
⑶根据上图中物质之间的转化关系及题中所给信息判断,B的化学式是_________。
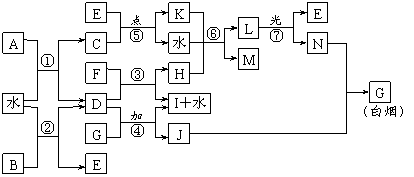
1.已知A、B均是由两种元素组成的化合物,A中某种元素的质量分数为75% ,B是一种淡黄色固体,C、J是同周期元素的气态氢化物,其中C是含氢量最高的烃,X为无色液体。反应生成的水均已略去。它们有如下图所示的关系。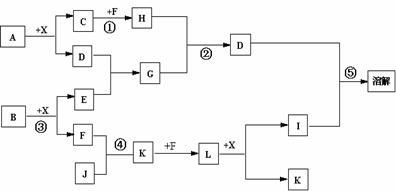
(1)写出化学式:A B J 。
(2)反应③中每生成1molF,转移电子的数目为: 。
(3)反应④的化学方程式为: 。
(4)写出离子方程式分别为:
反应② ;⑤ 。
(5)反应①中,每1.00gC与足量的F作用,恢复到25oC放出55.6kJ热量,写出反应①的热化学方程式 。
6、高中教材中有这样一个实验:在两支试管中分别加入3mL稀盐酸,将两个各装有0.3g NaHCO3或 Na2CO3粉末的小气球分别套在两支试管口。将气球内的NaHCO3或Na2CO3同时倒入试管中,观察到现象如下:
①试管中(填产生沉淀或气体及反应速率等相关现象)__________________________。
②盛______________的试管中气球变得更大, 大小气球
(包含试管) 体积之比约为(填最简单整数比)____________;
③甲同学用手触摸试管,发现盛NaHCO3粉末的试管变冷,而盛Na2CO3的试管温度升高。
由此他得出:不管其状态如何,NaHCO3和HCl反应为吸热反应,而Na2CO3和HCl反应为放热反应。类似如中和热,甲同学写出了下列热化学方程式(其中“aq”代表水合或无限稀释的含义):
HCO3-(aq)+ H+(aq) ==== H2O(l)+ CO2(g) ;△H>0
CO32-(aq)+ 2H+(aq)==== H2O(l) + CO2(g); △H<0
甲下结论的方法是否正确_________________________(填正确或不正确)
为研究是吸热还是放热反应,继续进行了下列实验(每次实验各做3次平行实验,取平均值):
|
序号 |
试剂1 |
试剂2 |
混合前温度 |
混合后最高或最低温度 |
|
① |
35mL水 |
2.5g
NaHCO3固体 |
20℃ |
18.5℃ |
|
② |
35mL水 |
3.2
Na2CO3固体 |
20℃ |
24.3℃ |
|
③ |
35mL稀盐酸 |
含2.5g NaHCO3的饱和溶液32.5mL |
20℃ |
19℃ |
|
④ |
35mL稀盐酸 |
含3.2g Na2CO3的饱和溶液23.1mL+10ml水 |
20℃ |
24.2℃ |
|
⑤ |
35mL稀盐酸 |
2.5gNaHCO3固体 |
20℃ |
16.2℃ |
|
⑥ |
35mL稀盐酸 |
3.2g
Na2CO3固体 |
20℃ |
25.1℃ |
请你帮助填写相关内容:
该研究报告的题目是《___________________________________________________》;
该实验中所用的仪器除试管、药匙(或V型纸槽)、气球、玻璃棒、烧杯、量筒、保温瓶外,还需要的仪器名称为______________和______________;
通过上述实验可得出五条结论
a:NaHCO3的溶解是_______(吸热或放热)过程;
b:Na2CO3的溶解是_______(吸热或放热)过程;
c:NaHCO3的饱和溶液和盐酸的反应是____________(吸热或放热)反应;
d:Na2CO3的饱和溶液和盐酸的反应是____________(吸热或放热)反应;
e:NaHCO3固体与稀盐酸反应的反应热是由________(填a→d的字母)的热效应之和。
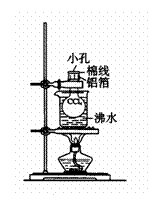
5、测定相对分子质量的实验步骤为(装置如下图):取一个干燥的250mL圆底烧瓶、封口用铝箔和棉线一起称量(称准到0.1g),得m1。往烧瓶内加入大约2mL四氯化碳(沸点为76.7℃),用铝箔和棉线封口并在铝箔上穿一小孔。把烧瓶迅速浸入盛于大烧杯内的沸水中,继续保持(水的)沸腾。待四氯化碳全部汽化后,从水中取出烧瓶冷却。擦干烧瓶外的水后称量(准确到0.1g),得m2。倒出瓶内液态四氯化碳,充满水,量体积(室温时水的密度大约为1g/cm3)。按理想气体公式pV=mRT/M求四氯化碳的相对分子质量(M)。式中p为压强(Pa),V为体积(L),m为四氯化碳的质量,R为气体常数(8.314J/K·mol),T为绝对温度。
 据此回答下列问题:
据此回答下列问题:
(1)把烧杯放入沸水中,为何要保持沸腾?
(2)如果在铝箔上开的孔较大,又在瓶内液态四氯化碳挥发完后过了一段时间才从热水中取出烧瓶,其它操作均正常。按以上不正确操作所得的实验数据求四氯化碳的相对分子质量将偏大还是偏小?
(3)用水充满烧瓶再量其体积,实验前忘了倒出原先在烧瓶内的液态四氯化碳,是否会对实验结果造成影响?
(4)把烧瓶放入沸水,要尽可能没入。事实上用这个装置测定时很难做到将烧瓶完全没入水中,而总有部分露在水面上(见图),这是否会对实验结果造成影响?
4、S2Cl2是一种金黄色易挥发的液体(熔点:-76℃,沸点:138℃),具有强烈的窒息性,且易与水发生水解反应,生成H2S、SO2、H2SO3、H2SO4等物质。人们使用它作橡胶硫化剂,使橡胶硫化,改变生橡胶热发粘、冷变硬的不良性能。
在熔融的硫中通以氯气即可生成S2Cl2。下图是实验室用S和Cl2制备S2Cl2的装置(夹持装置、加热装置均已略去)。
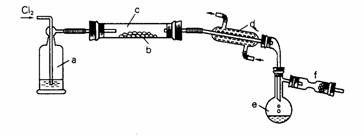
(1)已知S2Cl2分子结构与H2O2相似,请写出S2Cl2的电子式 。
(2)装置a中应放试剂为 ,其作用为 ;装置c为何水平放置 ;
装置d的名称是 ,它的作用是 。
(3)该实验的操作顺序应为 (用序号表示)。
①加热装置c ②通入Cl2 ③通冷凝水 ④停止通Cl2 ⑤停止加热装置
(4)图中f装置中应放置的试剂为 ,其作用为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com