
题目列表(包括答案和解析)
3.(★★★★)已知还原能力:I->Fe2+>Br-,则:
(1)少量Cl2通入FeI2(aq)中,反应的离子方程式是 ;
(2)过量Cl2通入FeI2(aq)中,反应的离子方程式是 ;
(3)将1.2 mol Cl2通入含有FeI2 1.0 mol的水溶液中: 。
2.(★★★★)(1)向NaHSO4(aq)中,逐滴加入Ba(OH)2(aq)至中性,写出发生反应的离子方程式_______________。
(2)在以上中性溶液中,继续滴加Ba(OH)2(aq),请写出此步反应的离子方程式_______________。
1.(★★★)完成下列反应的离子方程式。
(1)将NaAlO2(aq)和AlCl3(aq)混合: (水解相互促进,反应进行到底,下同);
(2)将10.00 mL 0.10 mol·L-1的NaHCO3(aq)与5.00 mL 0.10 mol·L-1的KAl(SO4)3(aq)混合: 。
4.多离子溶液中,离子得失电子的能力也是应该注意的。如得电子能力:Br2>Fe3+>I2。
●歼灭难点训练
3.原电池和电解池两极上的电极反应式叠加不一定是电池总反应的离子方程式。
2.离子方程式不仅遵循质量守恒定律,还遵循电荷守恒规律。水解相互促进离子方程式的配平,可先进行电荷守恒配平。
1.不是以自由移动离子参加反应的,不能写成离子的形式,包括难溶于水的强电解质、所有弱电解质和非电解质,都必须写成化学式的形式;这里特别需要指出的是某些易溶于水的强电解质,若没电离成自由移动的离子,也不能写成离子的形式,中学阶段常见的有:
①Cl2通入石灰乳中;
②用NaCl(或萤石)和浓H2SO4制取HCl(或HF);
③加热NH4Cl和Ca(OH)2的混合物制取NH3。
1.将Al2(SO4)3(aq)逐滴滴入Ba(OH)2(aq)中,写出可发生反应的离子方程式。
(1)__________________________________;
(2)__________________________________;
(3)__________________________________(可不写满,也可补充)。
●案例探究
[例题]已知Br2水与FeCl2(aq)发生如下反应:
3Br2+6FeCl2====4FeCl3+2FeBr3
现将112 mL(标准状况)Cl2通入10.0 mL 1.0 mol·L-1的FeBr2(aq)中,写出发生反应的离子方程式__________________。
命题意图:考查学生离子方程式的书写及比较物质还原性强弱的能力。
知识依托:①物质氧化性(或还原性)强弱的比较。②Cl2的氧化性。③离子方程式的书写。
错解分析:不进行定量分析,误写出下列离子方程式:
2Fe2++4Br-+3Cl2====2Fe3++2Br2+6Cl-
不进行还原性比较,误写出下列离子方程式:
2Br-+Cl2====2Cl-+Br2
解题思路:通过题给反应可比较出Fe3+与Br2的氧化性强弱(Br2强),从而明确Cl2通入FeBr2(aq)中先与Fe2+反应,若Cl2还有剩余再与Br-发生反应。
n(Cl2)=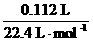 =5.00×10-3
mol
=5.00×10-3
mol
n(FeBr2)=10.0×10-3 L×1.0 mol·L-1=1.0×10-2 mol
这样,Fe2+可失去1.0×10-2 mol的电子,而Cl2最多得1.0×10-2 mol的电子,得失电子应守恒,故Br-不失电子。
答案:2Fe2++Cl2====2Fe3++2Cl-
●锦囊妙计
较难离子方程式的书写要注意以下问题:
4.(★★★★★)三聚氰酸[C3N3(OH)3]可用于消除汽车尾气中的氮氧化物(如NO2)。当加热至一定温度时,它发生如下分解:
C3N3(OH)3 3HNCO
3HNCO
产物HNCO(异氰酸,其结构H-N==C==O)能与NO2反应生成N2、CO2和H2O。
(1)写出HNCO与NO2反应的化学方程式:________。
(2)写出氧化产物与还原产物的质量之比________。
(3)要消除1.0 kg NO2需三聚氰酸[C3N3(OH)3]多少千克?
3.(★★★★)在热的稀硫酸中溶解了11.4 g硫酸铁,当加入50 mL 0.50 mol·L-1硝酸钾溶液时,其中的亚铁离子完全转化为铁离子,并有氮氧化物逸出:
____FeSO4+___KNO3+ _____ ___K2SO4+___Fe2(SO4)3+___NxOy↑+___H2O
___K2SO4+___Fe2(SO4)3+___NxOy↑+___H2O
(1)配平该化学方程式(将含x、y的计量数和所缺物质填在横线上)
(2)反应中起氧化作用的物质是________(写化学式)
(3)推算出x、y的数值:x=________,y=________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com