
题目列表(包括答案和解析)
19.(10分)工业上用固体硫酸亚铁制取颜料铁红(Fe2O3),反应原理是:
2FeSO4  Fe2O3+SO2↑+SO3↑。某研究性学习小组用下图所示装置检验该反应所产生的气态物质,然后用装置中A瓶内的混合物来测定已分解的FeSO4的质量。
Fe2O3+SO2↑+SO3↑。某研究性学习小组用下图所示装置检验该反应所产生的气态物质,然后用装置中A瓶内的混合物来测定已分解的FeSO4的质量。
(SO2沸点为-10.02℃)
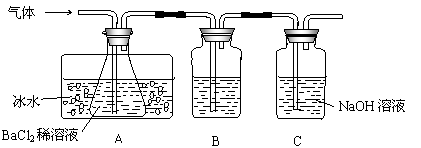
请回答相关问题:
(1)A瓶所盛试剂的作用是 ;B瓶所盛的试剂是 ;C瓶所盛试剂的作用是 。
(2)A瓶要用冷水冷却的原因是 。
(3)将此反应生成的气体通入A瓶BaCl2溶液中,则 。(填编号)
A.析出BaSO3沉淀 B.析出BaSO4沉淀
C.逸出SO3气体 D.逸出SO2气体
(4)反应后若用A瓶内的混合物来测定已分解的FeSO4的质量,其实验操作的第一步是(简述操作步骤) 。
18、某些盐在溶液中结晶时,析出的晶体是结晶水合物。下表记录了t℃的4份相同的硫酸铜溶液中加入的无水硫酸铜的质量以及析出的硫酸铜晶体(CuSO4·5H2O)的质量(温度维持不变)的实验数据
|
硫酸铜 |
Ⅰ |
Ⅱ |
Ⅲ |
Ⅳ |
|
加入的无水硫酸铜(g) |
2.5 |
4.0 |
6.0 |
8.0 |
|
析出的硫酸铜晶体(g) |
0.10 |
2.8 |
6.4 |
10.0 |
当加入4.6g无水硫酸铜时,析出硫酸铜晶体的质量为
A、3.42g B、3.88g C、6.82g D、2.56g
请将选择题答案填入下表:
第II卷(选择题 共78分)
17. AB3是短周期两种元素形成的化合物,已知B原子比A原子多一个电子层,且AB3分子中所有原子的最外层都满足8电子结构,则下列说法正确的是
A. A是IIIA族元素
B. AB3是三氧化硫
C. B的氢化物和A的氢化物都极易溶于水
D. B原子比A原子多10个电子
16、下列离子方程式不正确的是
A、三氯化铝溶液中加入过量氨水:Al3++3OH― Al(OH)3↓
Al(OH)3↓
B、4mol/L的NaAlO2溶液和7mol/L的HCl等体积互相均匀混合:
4AlO2―+7H++H2O 3Al(OH)3↓+Al3+
3Al(OH)3↓+Al3+
C、在Mn2+的溶液中加入HNO3再加入PbO2,得紫红色溶液:
5PbO2+2Mn2++4H+ 5Pb2++2MnO4-+2H2O
5Pb2++2MnO4-+2H2O
D、将0.1mol/L盐酸数滴缓缓滴入0.1mol/L25mLNa2CO3溶液中,并不断搅拌:
2H++CO32- CO2↑+H2O
CO2↑+H2O
15、对于平衡体系mA(g)+nB(g) pC(g)+qD(g);△H<0。下列结论中正确的是
pC(g)+qD(g);△H<0。下列结论中正确的是
A、若温度不变,将容器的体积增大1倍,此时A的浓度变为原来的0.48倍,
则m+n>p+q
B、若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为
m:n
C、若m+n=p+q,则往含有a mol气体的平衡体系中再加入b mol B,达到新平衡时,气体的总物质的量等于(a+b)
D、温度不变时,若压强增大至原来的2倍,达到新平衡时,总体积一定比原体积的1/2要小
14.配制250mL0.1 mol·L-1的盐酸时,下列实验操作将使配制溶液浓度偏大的是
A.用量筒量取所需浓盐酸俯视刻度线
B.定容时仰视刻度线
C.用量筒量取所需浓盐酸倒入烧杯后,再用水洗量筒2-3次,洗液倒入烧杯中
D.定容后倒转容量瓶几次,发现液面最低点低于标准,再补几滴水至标线
13.将一定量的Na-Al合金置于水中,合金完全溶解,得到20mL pH=14的溶液,然后用1 mol·L-1盐酸滴定至沉淀量最大时,消耗40mL盐酸,则原合金中钠的物质的量
A.0.01mol B.0.02molYCY C.0.03mol D.0.04mol
12. 一定质量的Na、K分别投入一定量的稀盐酸中,在相同条件下产生氢气的体积随时间变化的曲线如图中a、b所示,则下列说法中正确的是( )
一定质量的Na、K分别投入一定量的稀盐酸中,在相同条件下产生氢气的体积随时间变化的曲线如图中a、b所示,则下列说法中正确的是( )
A、投入的Na、K物质的量一定相等
B、曲线a对应的反应使用了催化剂
C、曲线a代表K的反应,曲线b代表Na
D、两反应中盐酸必须是足量的
11. 如图所示的两个实验装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.lmol/L,工作一段时间后,测得导线中均通过0.02mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中正确的是.
如图所示的两个实验装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.lmol/L,工作一段时间后,测得导线中均通过0.02mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中正确的是.
A.产生气体的体积:①>②
B.电极上析出物质的质量: ①>②
C.溶液的pH变化:①增大,②减小
D.电极反应式:
①中阳极: ;
;
②中阳极:
10. 10.30℃时,在0.1mol/L的Na2S、NaHS两溶液中均存在的关系是
A.c(H+)·c(OH-)>1×10-14 B.c(Na+)=c(S2-)+c(HS-)+c(H2S)
C.c(OH-)=c(H+)+c(HS-)+2c(H2S) D.c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com