
题目列表(包括答案和解析)
3.下列组成表示CxHy的烷、烯、炔烃的说法中,不正确的是( )
A.当x≤4时常温常压下均为气体
B.y一定是偶数
C.分别完全燃烧1mol,耗O2为(x+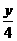 )mol
)mol
D.x相同,等质量的烷、烯、炔烃完全燃烧生成的CO2量相同
2.1mol某烃在氧气中充分燃烧,需要消耗氧气179.2L(标准状况下)。它在光照条件下与氯气反应能生成三种不同的一氯取代物。该烃的结构简式是( )

1.下列反应的生成物为纯净物的是( )
A.甲烷和氯气光照 B.乙烯的加聚
C乙烯和HCl加成 D.电石加水
26、(12分)在NO2和O2的混合气体中,NO2所占的体积分数为x。用容积为50mL的容器盛满该混合气体并倒立于水中,足够长的时间后,容器内剩余VmL气体。
⑴试确定x的取值范围与剩余气体体积V的函数关系:V=f(x)。
⑵若最终剩余10mL气体,则原混合气体中NO2的体积分数是多少?
⑶若原50mL混合气体中含有少量N2(小于1mL),请判断在上述条件下,这些N2的存在对第⑵题的计算结果有无影响。
25.(6分)环保检测部门测定某气体样品中含一氧化碳的含量,其方法和实验步骤如下:
① 将2.000L的气体样品通过盛有I2O5固体的加热管,发生的反应为:
5CO + I2O5  5CO2
+ I2。
5CO2
+ I2。
② 将所产生的碘升华,并加入30.00mL 0.0050 mol·L-1的硫代硫酸钠溶液,发生的反应为:
I2 + 2S2O32- = 2I-+ S4O62-
③ 将②中溶液取出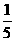 ,加入1.000mL 0.0100 mol·L-1的碘水,正好将所取溶液中过量的Na2S2O3全部氧化。
,加入1.000mL 0.0100 mol·L-1的碘水,正好将所取溶液中过量的Na2S2O3全部氧化。
试计算1L该气体样品中有多少毫克(mg)的CO?
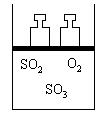
24. (10分)如右图所示,将4molSO2和2molO2混合置于体积可变的等压容器中,在一定温度下发生如下反应:2SO2(g)+O2(g)
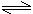 2SO3(g);ΔH<0。该反应达到平衡状态A时,测得气体总物质的量为4.2mol。
2SO3(g);ΔH<0。该反应达到平衡状态A时,测得气体总物质的量为4.2mol。
若SO2、O2、SO3的起始物质的量分别用a、b、c 表示,回答下列问题:
(1)在达到平衡状态A的容器中通入少量O2,体系中SO2的体积分数_________(填“增大”或“减小”或“不变”),若要使SO2的体积分数再变到与平衡状态A相同,可采取的措施有:______________________或_____________________。
(2)若起始时a=1.2mol,b=0.6mol,且达到平衡后各气体的体积分数与平衡状态A相同,则起始时c的取值为___________。
(3)若要使反就开始时向逆反应方向进行,且达到平衡后各气体的物质的量与平衡状态A相同,则起始时c的取值范围是____。
23.(10分)已知A、B、C、D、E为中学常见的五种物质,均含元素Y,有的还可能含有元素X、Z,元素X、Y、Z的原子序数依次递增。
①元素Y在A、B、C、D、E中所呈化合价依次递增,其中只有B为单质。
②常温下将气体D通入水中发生反应,生成C和E。
③工业上以A、空气和水为原料,通过催化氧化法制成E。
请回答以下问题:
(1)A分子的空间构型是 ;B分子的电子式为 ;含Y元素的氧化物且属于酸酐还有:________ 。
(2)写出②中反应的化学方程式: 。
(3)由B反应生成1molA放出的热量为46.2kJ,写出该反应的热化学方程式:
__________________________________________________________________________
 (4)工业上,若输送Cl2的管道漏气,用A进行检验时可观察到大量白烟,同时有B生成,写出有关反应化学方程式:
;若反应有6NA ( NA表示阿伏加德罗常数)电子发生转移,则有
mol的A被氧化。
(4)工业上,若输送Cl2的管道漏气,用A进行检验时可观察到大量白烟,同时有B生成,写出有关反应化学方程式:
;若反应有6NA ( NA表示阿伏加德罗常数)电子发生转移,则有
mol的A被氧化。
22、(8分)麻醉剂的发现和使用,是人类医疗史上了不起的一项成就,它可使患者在接受治疗时感觉不到疼痛。
(1)笑气是人类最早应用于医疗的麻醉剂之一,它可由NH4NO3在微热条件下分解产生,产物除N2O外还有一种,此反应的化学方程式为
。有关理论认为N2O与CO2分子具有相似的结构(包括电子式),则其空间构型是 型,N2O为 分子(极性或非极性)
(2)另一种麻醉剂为乙醚(C2H5-O-C2H5),乙醚和正丁醇(C4H9OH)互为同分异构体,但两者之间沸点差异较大,其中沸点高的是(填名称)_______________,沸点高的原因是___________________________________________。
21.(10分)甲状腺激素对于人和高等动物具有极其重要的生理作用,下图是关于碘及其化合物与甲状腺素的转化网络图示。
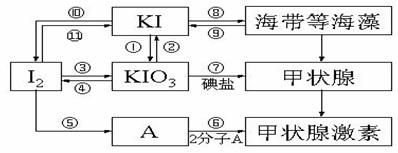
(1)请写出在强酸性条件下,由KI和KIO3反应制得I2的离子反应方程式:_____________________________________________________________________。
(2)上述各反应中,碘元素发生氧化反应的过程有_________________ (填序号)。
(3)制备KIO3的方法较多:
③的原理是I2在一定条件下还原KClO3,写出该反应的化学方程式:________
_____________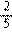
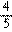
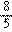 ___________________________________________。
___________________________________________。
① 的原理是以石墨为阳极,不锈钢为阴极,KI溶液为电解质溶液(混有K2Cr2O7)电解,总反应方程式为KI+3H2O KIO3+3H2↑。①试写出阴极反应方程式:________
______________________________________________________________。
KIO3+3H2↑。①试写出阴极反应方程式:________
______________________________________________________________。
20.(12分)已知某纯碱试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用下图中的装置进行实验。
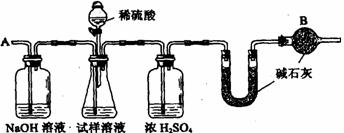
主要实验步骤如下:
① 按图组装仪器,并检查装置的气密性
② 用托盘天平称取6.0 g试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液
③ 称量盛有碱石灰的U型管的质量得到32.6 g
④ 从分液漏斗滴入6 mol·L-1的硫酸,直到不再产生气体时为止
⑤ 从导管A处缓缓鼓入一定量的空气
⑥ 再次称量盛有碱石灰的U型管的质量,得到34.8 g
⑦ 重复步骤⑤和⑥的操作,直到U型管的质量基本不变。
请填空和回答问题:
(1)在③步骤中称量质量时涉及到多步添加,撤去法码的操作,请用“↓”表示在托盘上加上砝码,“↑”表示从托盘上取下砝码的称量过程。(法码有50g、20g、10g、5g、2g、1g等多种规格,1g以下移动游码)注:表格可不填满
|
砝码质量/g |
50 |
20 |
|
|
|
|
|
|
|
|
称量过程 |
↓↑ |
|
|
|
|
|
|
|
|
(2)装置中干燥管B的作用是
(3)如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果 (填偏高、偏低或不变)
(4)步骤⑤的目的是_____________________________、A中NaOH溶液的作用是________________________________________________________________。
(5)步骤⑦的目的是
(6)该试样中纯碱的质量分数为(精确到0.1) .
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com