
题目列表(包括答案和解析)
定量实验:
一定量浓度溶液的配制(一册56页或一册167页)
① 步骤:计算、称量、溶解、冷却、转移、洗涤、定容、摇匀
② 根据上述步骤回忆所需仪器。
酸碱中和滴定(二册69页或二册227页)
① 准备:检漏、水洗、润洗、装液、排气泡、调液面、读数
② 操作:左手控制滴定管、右手震荡锥形瓶、眼睛注视锥形瓶内溶液颜色的变化
③ 滴定终点的判断
④ 读数视线、刻度、凹液面的最低处,三者同在一水平线上。
⑤ 根据上述过程回忆所需仪器
⑥ 误差分析
硫酸铜晶体中结晶水含量的测定(三册11页)
① 所需实验用品
② 步骤:
③ 本实验中至少需要称量四次,哪四次?
④ 如何判断CuSO4已经完全失水?
⑤ 误差分析
中和热的测定(三册45页)
① 该实验所需实验用品(大烧杯、小烧杯、温度计、量筒两个、泡沫塑料板或硬纸板、环形玻璃搅拌棒)
② 在此实验中,使其中一种反应物过量目的是什么?
③ 在完成一次实验过程中需要称量几次温度?
在此实验中,如果用NaOH固体、浓硫酸、醋酸、氨水会使实验结果如何变化?
④数据的处理和误差的分析
性质实验:
利用Na2S2O3溶液与H2SO4的反应来进行浓度对化学反应速率的影响(实验现象、方程式)
利用FeCl3与KSCN的反应来进行浓度对平衡的影响(现象、方程式、Cl-和K+对平衡的影响)
Fe与水反应的实验(二册88页)及方程式
醛的性质实验(二册165页两个反应)
银氨溶液的配制过程和配制原理
银镜反应的方程式、反应条件
新制Cu(OH)2的配制过程及NaOH大大过量
醛与新制Cu(OH)2的方程式及反应条件
乙二酸的性质(三册82页)
乙二酸的酸性
乙二酸与Na2CO3溶液的反应
乙二酸受热分解的装置、方程式、反应产物的判断
乙二酸溶液中滴入酸性KMnO4
乙二酸与乙二醇反应的装置、方程式
乙二酸能使蓝墨水褪色
制取实验:
Cl2的制取(一册67页)
① 反应装置、尾气处理
② 反应原理及方程式
③ 如何除去氯气中的氯化氢
④ 实验室还可以用下列原理快速、制取少量氯气:
浓盐酸+ KMnO4、浓盐酸+ KClO3、
NH3的制取(二册13页)
① 反应装置及原理(方程式)
② 实验室还可以用下列原理快速、制取少量氨气:
浓氨水+ CaO、浓氨水+ NaOH、浓氨水受热分解
FeCl3 、FeCl2、SnCl2溶液的配制(二册66页)
主要是考虑水解、易被氧化
Fe(OH)2的制取(二册89页)
① 新制的FeSO4溶液、煮沸过的NaOH、滴管需插入液面以下、防此被空气中的氧气氧化
② Fe(OH)2在空气中的变质过程及方程式
乙烯的实验室制备(二册122页)
① 装置(特别是温度计的位置)
② 反应方程式及浓硫酸的作用
③ 投料量弄硫酸和乙醇(体积比:1/3)、温度的控制、碎瓷片的作用
石油的蒸馏(二册137页)
① 装置(温度计的位置、水流方向)
② 馏分仍是混合物
溴苯的制取、硝基苯的制取(高考金典的随堂练习)
醇分子中结构式的探讨(二册158页)
①反应的装置(特别是排水法收集气体的方法)
②该实验安全、顺利进行的关键实验步骤:检查实验装置的气密性;加入稍过量的金属钠;从漏斗中缓慢滴加无水乙醇。
③在对量筒进行读数时,要上下移动量筒使量筒中的液面与广口瓶中的液面相持平
银氨溶液的配制(二册165页)
向AgNO3溶液中逐滴加入氨水,直至最初产生的沉淀恰好完全溶解为止,这时所得到的溶液即为银氨溶液
乙酸乙酯的制取(二册168页或235页)
① 反应的装置(导管为什么不能插入液面以下?)
② Na2CO3溶液的作用、反应条件及方程式
③ 如何混合乙醇、乙酸、浓硫酸
酯的水解(二册169页)
反应的条件
皂化反应(二册235页)
① 所需仪器
② 乙醇的作用、NaOH溶液的作用、饱和NaCl溶液的作用
③ 如何分离皂化反应的产物从而来制取肥皂?
Fe(OH)3胶体的制取(三册15页)
向沸水中加入FeCl3饱和溶液,继续煮沸,待溶液呈红褐色,此时即为Fe(OH)3胶体
Al(OH)3制取的最佳方案(三册79页)
① 铝表面油污的洗涤
② Al(OH)3制取的最佳方案
③ 该实验中,通过热蒸馏水,利用倾析法对沉淀进行洗涤
④ 溶液pH的调整
硫酸亚铁的制备(三册81页)
① 工业中废铁屑表面的油污如何除去?
② 为里防此铁锈与硫酸生成含有Fe3+的溶液,在实验中应使铁屑过量
③ 本实验是利用重结晶法来制取硫酸亚铁
④ 为了增大硫酸亚铁的溶解量,在实验中给溶液进行了加热
⑤ 为了减少过滤时硫酸亚铁的损失,应将溶液进行热过滤
[反馈训练]
1.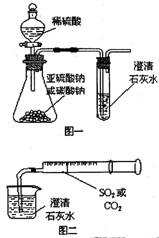 某同学用如图一所示的装置来探究CO2、SO2与澄清石灰水的反应,结果通入CO2可以看到先浑浊后澄清的现象,但通入SO2没有看到浑浊现象。经过思考分析后,该同学改用图二的装置,将气体收集在注射器,缓缓地将气体一个气泡一个气泡地通入澄清石灰水中,都能看到石灰水先变浑浊再澄清的现象。
某同学用如图一所示的装置来探究CO2、SO2与澄清石灰水的反应,结果通入CO2可以看到先浑浊后澄清的现象,但通入SO2没有看到浑浊现象。经过思考分析后,该同学改用图二的装置,将气体收集在注射器,缓缓地将气体一个气泡一个气泡地通入澄清石灰水中,都能看到石灰水先变浑浊再澄清的现象。
⑴本实验中生成CO2和SO2的有关反应的化学方程式为:
_________________________;________________________。
⑵对比分析两组实验,你认为用图一装置实验时,通入SO2不能出现浑浊的原因可能是:___________________。
⑶用图二装置进行实验,以相同速率通入CO2和SO2时,SO2产生浑浊、澄清的现象比CO2快的原因可能是:
____________________________________。
⑷用图一进行SO2与石灰水反应的实验时,从安全或环境角度考虑,该装置可如何改进?
________________________________________________________________________。
答案:⑴Na2CO3+H2SO4=Na2SO4+CO2↑+H2O Na2SO3+H2SO4=Na2SO4+SO2↑+H2O
⑵SO2溶解度大,与石灰水反应时SO2过量,直接生成酸式盐而看不到沉淀
⑶SO2溶解度大,且对应的亚硫酸酸性比碳酸强,SO2与石灰水比CO2反应快
⑷增加尾气吸收装置或增加防倒吸装置
下列实验操作不正确的是
21.定性:晶体由蓝色由变成白色粉末,且不再有水蒸气逸出。
定量:最后两次称量误差不超过0.1g(用天平称量)
20.当加入最后一滴溶液,锥形瓶内溶液颜色恰好发生明显变化,且在30秒内不改变,此时即为滴定的终点。
19.把密度大溶液的沿烧杯缓慢加入到密度小的溶液中,并用玻棒不断的搅拌。
17.先向Na2CO3溶液中加入酚酞,溶液呈红色,然后在加入CaCl2至沉淀完全,溶液红色消失。
14.用玻棒沾取一滴混合物加入到水中,在液体表面不在形成油滴(或者油脂全部消失)
9.打开分液漏斗上口活塞,旋开分液漏斗的旋塞,缓慢滴加
8.第二册课本228爷
7.用玻棒沾取待测液点滴与试纸的中央,并在30s内与标准比色卡进行对比,进行读数。
6. 加入强碱加热,能否释放出碱性气体。用湿润的红色石蕊试纸看是否变蓝。
用湿润的KI淀粉试纸,看是否变蓝。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com