
题目列表(包括答案和解析)
11.(11分)物质的转化关系如下图所示(有的反应可能在水溶液中进行)。其中A为化合物,甲可由两种单质直接化合得到,乙为金属单质,G为酸,乙在G的浓溶液中发生钝化。
(1)若A为黄色固体,C能使品红试液褪色,D的水溶液中加入HNO3酸化的AgNO3溶液有白色沉淀生成。则
①工业上反应I在 中进行,反应Ⅲ在 (均填设备名称)中进行。
②由两种单质直接化合得到甲的反应条件是 或 。
③反应I的化学方程式是 。
(2)若甲为淡黄色固体,D、F的溶液均呈碱性,用两根玻璃棒分别蘸取A、G的浓溶液并使它们接近,有大量白烟生成。则①甲的电子式是 。
②D的溶液与乙反应的离子方程式是 。
③若1.7gA与O2反应生成气态的B和C时放出22.67kJ热量,写出该反应的热化学方程式:
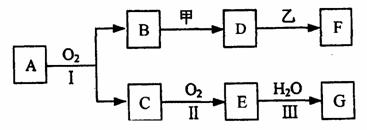
10.(10分)已知A为中学化学中的常见金属,X、Y为常见非金属。X、E、F、G、J常温下为气体,C为无色液体,B是一种盐,受热易分解。现用A与石墨作电极,B的浓溶液作电解质,构成原电池。有关物质之间的转化关系如下图(部分反应的条件、生成物被略去):

请填写下列空白:
⑴金属A为 ;操作a是将D溶液在HCl气流中蒸干,原因是
⑵反应②的化学方程式为: ;
反应⑤的化学方程式为: 。
⑶原电池反应①中,正极反应式为: 。
8.钡和钠相似,也能形成含O22-离子的过氧化物,下列叙述不正确的是
A.过氧化钡的化学式是Ba2O2
 B.1 mol过氧化钡或过氧化钠跟足量的水反应都生成0.5 mol氧气
B.1 mol过氧化钡或过氧化钠跟足量的水反应都生成0.5 mol氧气
C.O22-离子的电子式为
D.过氧化钡或过氧化钠都是强氧化剂
7.把铝粉和某铁氧化物xFeO·yFe2O3粉末配成铝热剂,再分成两等份。一份在高温下恰好完全反应后,再与足量盐酸反应;另一份直接放人足量的烧碱溶液中充分反应。前后两种情况下生成的气体质量比是5:7,则x:y为
A.1 : 2 B.1 : 1 C. 5 : 7 D. 7 : 5
6.向一定量的Fe、FeO、Fe2O3的混合物中,加入100mL l moL/L的盐酸;恰好使混合物完全溶解并放出标准状况下224mL气体。向所得溶液中加入KSCN溶液无血红色出现,若用足量的CO在高温下还原相同质量的此混合物,能得到单质铁的质量为
A.11.2g B.2.8g C.5.6g D.无法计算
5.下列反应的离子方程式正确的是
A.向苯酚钠溶液中通入少量二氧化碳:CO2+H2O+2C6H5O-→2C6H5OH+CO32-
B.向氯化铝溶液中加入过量氢氧化钠溶液:Al3++4OH-=A1O2-+2H2O
C.硫酸亚铁溶液中加入酸化的双氧水:Fe2++2H++H2O2=Fe3++2H2O
D.将少量硝酸银溶液滴入氨水中:Ag++2NH3·H2O=[Ag(NH3)2]++2H2O
4. 甲、乙两烧杯中各盛有100mL3 mol·L-1的盐酸和氢氧化钠溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为甲:乙 = 1:2,则加入铝粉的质量为
A.5.4g B.3.6g C.2.7g D.1.8g
3. MgCl2和NaHCO3按物质的量之比1:2混合制成溶液,加热蒸干得到的固体是
A. Mg(HCO3)2和NaCl B. Mg(OH)2和NaCl
C. MgCl2和Na2CO3 D. MgCO3和NaCl
2. 将镁在空气中燃烧的全部产物溶解在80mL浓度为2.375mol·L-1盐酸中,用40mL0.9 mol·L-1氢氧化钠溶液中和多余盐酸,然后在此溶液中再加入过量的氢氧化钠溶液,把生成的NH3全部用足量的盐酸吸收,经测定氨为0.646g,则燃烧掉镁的质量为(已知Mg3N2与盐酸反应生成MgCl2和NH4Cl)
A. 1.392g B. 2.59g C. 3.46g D. 1.68g
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com