
题目列表(包括答案和解析)
20.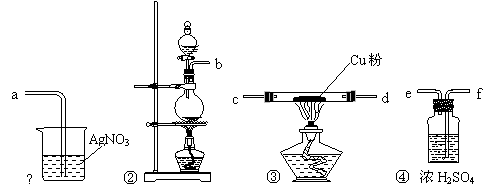 (10分)为了证明在实验室制备Cl2的过程中会有HCl挥发出来,甲同学设计了如下图所示的实验装置,按要求回答下列问题。
(10分)为了证明在实验室制备Cl2的过程中会有HCl挥发出来,甲同学设计了如下图所示的实验装置,按要求回答下列问题。
⑴请根据甲同学的意图,连接相应的装置,接口顺序:b接 , 接 , 接a。
⑵实验开始前应先进行的操作是_____________。
⑶装置中Cu的作用______________________________________(用方程式表示)。
 ⑷乙同学认为甲同学实验中有缺陷,不能证明最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液中的气体只有一种,乙同学提出在某两个装置之间再加装置⑤。
⑷乙同学认为甲同学实验中有缺陷,不能证明最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液中的气体只有一种,乙同学提出在某两个装置之间再加装置⑤。
你认为装置⑤应加在 之间(填序号)。瓶中可以放入
。如果实验结论可靠,应观察到的现象
。
⑸丙同学看到乙同学设计的装置后提出无需多加装置,只需将原来烧杯
中的AgNO3溶液换掉。你认为应将溶液换成 ,如果观察到
的现象,则说明甲的实验不可靠。
19.Ⅰ(4分)下列说法中,正确的有
①用试管夹夹持试管时,试管夹从试管底部往上套,夹在试管的中上部
②给盛有液体的体积超过三分之一的试管加热至沸腾
③硝酸、溴水可长期盛放在棕色的滴瓶中
④将试管平放,用纸槽往试管里送入固体粉末后,然后竖立试管
⑤熔融氢氧化钠要在耐高温的石英坩埚中
⑥将烧瓶放在桌上,再用力塞进塞子
Ⅱ(8分)某种胃药片的制酸剂为碳酸钙,某实验小组的同学测其所含碳酸钙的质量,有如下操作:
①需配制0.1 mol·L-1 的盐酸和0.1mol·L-1 的氢氧化钠溶液;
②每次取一粒(药片质量均相同)0.2g的此胃药片,磨碎后加入20.00mL蒸馏水;
③以酚酞为指示剂,用0.1mol·L-1 的氢氧化钠溶液滴定,需用去VmL达滴定终点;
④加入25.00mL0.1mol·L-1 的盐酸溶液。
⑴甲实验过程的步骤为①②④③,乙实验过程的步骤为①②④③②④③,请根据你的实验经历判断 更合理。
⑵下图所示的仪器中配制0.1mol·L-1 盐酸溶液和0.1mol·L-1 氢氧化钠溶液肯定不需要的仪器是(填序号)____,配制上述溶液还需要的玻璃仪器是(填仪器名称) 。
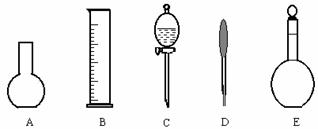
⑶配制上述溶液应选用的容量瓶的规格是(填字母)__________________。
①50mL、50mL ②100mL、100mL ③100mL、150mL ④250mL、250mL
18.T℃时,A气体与B气体反应生成C气体。反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是

A.在(t1+10)min时,保持其他条件不变,增大压强,平衡向逆反应方向移动
B.(t1+10)min时,保持容器体积不变,通入稀有气体,平衡向逆反应方向移动
C.T℃时,在相同容器中,若由0.3mol·L-1 A、0.1 mol·L-1 B和0.4 mol·L-1 C反应,达到平衡后,C的浓度仍为0.4 mol·L-1
D.其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大
第Ⅱ卷(非选择题 共76分)
17.将一定质量的镁和铝的混合物投入100 mL盐酸中,固体全部溶解后,向所得溶液中
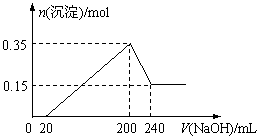 加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。若不考虑金属和盐酸反应时HCl的挥发,则下列
加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。若不考虑金属和盐酸反应时HCl的挥发,则下列
说法正确的是
A.镁和铝的总质量为9 g
B.盐酸的物质的量浓度为5 mol·L-1
C.NaOH溶液的物质的量浓度为5 mol·L-1
D.生成的氢气在标准状况下的体积为11.2 L
16.关于某无色溶液中所含离子的鉴别,下列判断正确的是
A.加入AgNO3溶液,生成白色沉淀,加稀盐酸沉淀不消失,可确定有Cl-存在
B.加入Ba(NO3)2溶液,生成白色沉淀,加稀盐酸沉淀不消失,可确定有SO42-存在
C.通入Cl2后,溶液变为黄色,加入淀粉溶液后溶液变蓝,可确定有I-存在
D.加入盐酸,生成的气体能使澄清石灰水变浑浊,则原溶液中一定有大量CO32-
15. 已知NaHSO3溶液呈酸性、NaHCO3溶液呈碱性。现有浓度均为0.1 mol·L-1的NaHSO3溶液和NaHCO3溶液,溶液中各粒子的物质的量浓度存在下列关系(R表示S或C),其中正确的是
A.c(Na+)=c(HRO3-)+c(RO32-)+c(H 2RO3)
B.c(Na+)+c(H+)=c(HRO3-)+c(RO32-)+c(OH-)
C.c(H+)+c(H2RO3)=c(RO32-)+c(OH-)
D.两溶液中c(Na+)、c(HRO3-)、c(RO32-)分别相等
14.室温下,某无色透明溶液中由水电离出来的H+和OH-浓度的乘积为1×10-24,则此溶液中可能大量共存的离子组为
A.HCO3-、Al3+、Na+、SO42- B.I-、NO3-、K+、NH4+
C.MnO4-、Cl-、SO42-、K+ D.SiO32-、SO32-、Na+、Cl-
13.NA表示阿伏加德罗常数,下列叙述中不正确的是
A.标准状况下,80g SO3中含3NA个氧原子,体积小于22.4L
B.23 g Na和足量的O2完全反应,无论是常温,还是燃烧,都失去NA个电子
C.含有2NA个阴离子的CaC2,在标准状况下,能产生约44.8L的乙炔气体
D.1molNa218O2与足量的H2O完全反应时转移电子2NA个,生成NaOH80g
12.将一元酸HA的溶液与一元碱BOH的溶液等体积混合,若所得溶液显酸性,下列有关判断正确的是
A.若混合前酸、碱pH之和等于14,则HA肯定是弱酸
B.若混合前酸、碱物质的量浓度相同,则HA肯定是弱酸
C.溶液中水的电离程度:混合溶液>纯水>BOH溶液
D.混合溶液中离子浓度不一定满足: c(A-)>c(B+)>c(H+)>c(OH-)
11.对于平衡体系mA(g)+nB(g) pC(g)+qD(g);△H<0。下列结论中正确的是
pC(g)+qD(g);△H<0。下列结论中正确的是
A.若平衡时A、B的转化率之比为m∶n,说明反应开始时,A、B的物质的量相等
B.若温度不变,将容器的体积增大1倍,此时A的浓度变为原来的0.45倍,则m+n>p+q
C.若m+n=p+q,则往含有a mol气体的平衡体系中再加入b mol B,达到新平衡时,气体的总物质的量等于(a+b)mol
D.若升高温度时,平衡混合气体的平均相对分子质量增大,则m+n>p+q
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com