
题目列表(包括答案和解析)
2.(★★★★) 14.0 g铜银合金与足量某浓度的硝酸反应,将放出的气体与1.12 L(标准状况)氧气混合,通入水中恰好完全吸收,则合金中铜的质量为( )
A.9.6 g B.6.4 g C.3.2 g D.1.6 g
1.(★★★)向50 mL 18 mol·L-1 H2SO4溶液中加入足量的铜片并加热,充分反应后,被还原H2SO4的物质的量( )
A.小于0.45 mol B.等于0.45 mol
C.在0.45 mol和0.90 mol之间 D.大于0.90 mol
0.6Cu+2.2HNO3====0.6Cu(NO3)2+xNO2↑+(1-x)NO↑+1.1H2O
先写出反应物和生成物以及Cu、NO2和NO的化学计量数,再根据Cu原子守恒和N原子守恒得出Cu(NO3)2和HNO3的化学计量数,H2O的化学计量数可根据N原子守恒而得出(因与结果无关也可不算出)。
根据方程式及有效数字的运算规则,可知参加反应的HNO3物质的量为2.20 mmol。
方法4(平均分子式法):设HNO3还原产物的平均分子式为NOx,则:
n(Cu)∶n(NOx)=0.600 mmol∶1.00 mmol=3∶5
Cu与HNO3的总反应方程式为:
3Cu+11HNO3====3Cu(NO3)2+5NOx↑+?H2O
先写出反应物和生成物及Cu和NOx的化学计量数3和5,再根据Cu原子守恒和N原子守恒分别得出Cu(NO3)2和HNO3的化学计量数3和11,H2O的化学计量数因与结果无关可不算出,则:
n(HNO3)=11/3n(Cu)=0.600 mmol×11/3=2.20 mmol
答案:C
变式1:去掉备选项,将问题改为:求还原产物NO2和NO的物质的量之比,其他同例题,试解之。
解题思路:在前面“方法4”的基础上得到下式:
3Cu+11HNO3====3Cu(NO3)2+5NOx+5.5H2O
根据O原子守恒得:
33=18+5x+5.5
x=1.9
即NOx为NO1.9。用十字交叉法:
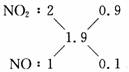
V(NO2)∶V(NO)=9∶1
答案:9∶1
变式2:若例题条件下Cu与HNO3恰好完全反应,二者皆无剩余,欲求开始生成NO时HNO3溶液的浓度,还缺少的条件是________(用必要的文字和字母b表示),开始生成NO时HNO3溶液的浓度为________(请写最后结果)。
解题思路:据变式1解题思路得:
V(NO2)=1.00 mmol×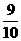 =0.900 mmol
=0.900 mmol
V(NO)=0.100 mmol
生成NO消耗HNO3的物质的量可求:
8HNO3(稀)~2NO↑
8 2
n(HNO3) 0.100 mmol
n(HNO3)=0.400 mmol
欲求0.400 mmol HNO3的浓度,须知HNO3(aq)的体积--b:
c(HNO3)=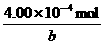
答案:开始生成NO时HNO3(aq)的体积b 4.00×10-4 mol/b
●锦囊妙计
当化学反应进行时,反应物不断被消耗。随反应的进行,反应物浓度不断改变,①有的会造成产物的不同。如,过量Cu放入少量浓HNO3中,开始生成的气体是NO2,后来生成的气体是NO;很稀的HNO3溶液与活泼金属反应还会有H2生成(非信息题可不考虑)。再如,过量活泼金属(如Zn)与少量浓H2SO4的反应,开始时生成的气体是SO2,后来生成的气体是H2。②有的反应不再发生。如,过量Cu与少量浓H2SO4的反应,随反应的进行,浓H2SO4变成了稀H2SO4,Cu与稀H2SO4不再发生反应。再如,过量MnO2与少量浓盐酸的反应,随反应的进行,浓盐酸变成稀盐酸,不再与MnO2发生氧化还原反应。③有些本来不能发生的反应,后来能够进行。如稀H2SO4溅在衣服上,水分蒸发后,变成浓H2SO4,也就能使布料脱水炭化。
●歼灭难点训练
4.(★★★★★)制取氨气并完成喷泉实验。
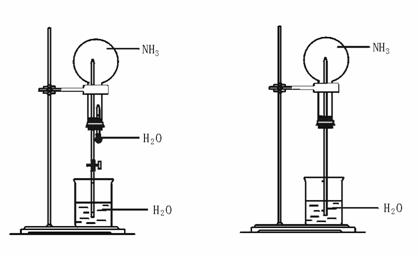
图42-6 图42-7
(1)写出实验室制取NH3的化学方程式: 。
(2)收集NH3应使用________法,要得到干燥的NH3可选用________做干燥剂。
(3)用图42-6装置进行喷泉实验,上部烧瓶已装满干燥NH3,引发水上喷的操作是________;该实验的原理是 。
(4)如果只提供如图42-7的装置,请说明引发喷泉的方法 。
3.(★★★★)喷泉是一种常见的自然现象,其产生原因是存在压强差。
(1)图42-4为化学教学中所用的喷泉实验装置。在烧瓶中充满干燥气体,胶头滴管及烧杯中分别盛有液体。下列组合中不可能形成喷泉的是
A.HCl和H2O
BNO2和H2O
C.NH3和H2O
DNCO2和NaOH(aq)
(2)某学生积极思考产生喷泉的其他办法,并设计了如图42-5所示的装置。 图42-4
①在图42-5的锥形瓶中,分别加入足量的下列物质,反应后可能产生喷泉的是
A.Cu与稀盐酸 B.NaHCO3与NaOH(aq)
C.CaCO3与稀硫酸 D.NH4HCO3与稀盐酸
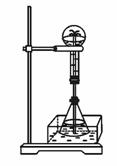 ②在图42-5锥形瓶外放一水槽,锥形瓶中加入酒精,水槽中加入冰水后,再加入足量的下列物质,结果也产生了喷泉。水槽中加入的物质可以是
②在图42-5锥形瓶外放一水槽,锥形瓶中加入酒精,水槽中加入冰水后,再加入足量的下列物质,结果也产生了喷泉。水槽中加入的物质可以是
A.浓硫酸 B.食盐
C.硝酸钾 D.硫酸铜
这种方法产生喷泉的原理是____________。
③比较图42-4和图42-5两套装置,从产生喷泉的原理来分析,图42-5是___________上部烧瓶内气体压强,图42-5是___________下部锥形瓶内气体压强(均填“增大”或“减小”)。 图42-5
(3)城市中常见的人造喷泉及火山爆发的原理与上述___________(填图42-4或图42-5)装置的原理相似。
2.(★★★★)如图43-3,同温同压下,两个等体积的干燥圆底烧瓶中分别充满①NH3、②NO2,进行喷泉实验。经充分反应后,瓶内溶液的物质的量浓度为
A.①>② B.①<② C.①=② D.不能确定
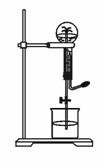
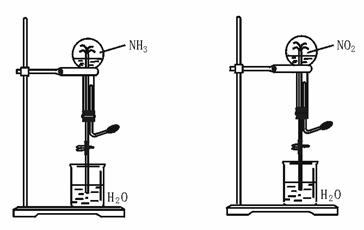
图42-3
1.(★★★)在体积为1 L的干燥烧瓶中,用排空气法充入HCl气体后,测得烧瓶中气体对氧气的相对密度为1.082,以此气体进行喷泉实验,当喷泉停止后,进入烧瓶中的液体体积是
A.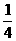 L B.
L B.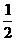 L C.
L C.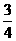 L D.全满
L D.全满
3.喷泉的设计
关键是如何使烧瓶内的气体大量地减少。
●歼灭难点训练
2.喷泉的计算
根据充入烧瓶中液体的体积可以计算烧瓶内所盛气体的纯度或平均式量。
1.形成喷泉的组合
(1)NH3、HCl、SO2、NO2与水组合能形成喷泉。
(2)酸性气体与NaOH(aq)组合能形成喷泉。
(3)有机气体与有机溶剂组合也能形成喷泉。
(4)O2、N2、H2等不溶于水的气体,设计一定实验条件将其反应掉,也能形成喷泉。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com