
题目列表(包括答案和解析)
9.关于右图所示装置的说法正确的是( )
A.电流表指针将不会转动
B.外电路中电流方向是Al→Mg
C.Mg是负极,电极反应式为:Mg-2e-=Mg2+
D.Al是负极,电极反应式为:Al+4OH--3e-=AlO2- +2H2O
8.泽维尔用飞秒(时间单位:1飞秒=10-15秒)激光技术研究了氰化碘(ICN)
的分解反应 ICN→I+CN,发现该变化可在200飞秒内完成。已知(CN)2和卤
素的性质相似。以下有关ICN的叙述中正确的是
A、ICN不能和NaOH溶液反应; B、ICN是一种共价化合物;
C、将ICN加入到氯水中可生成I2; D、ICN的晶体是离子晶体。

7.下列溶液中: ①石灰水 ②H2S溶液 ③KMnO4溶液 ④溴水 ⑤酸化的Ba(NO3)2溶液 ⑥品红溶液,不能区别SO2和CO2气体的是
A.只有① B.①③ C. ①②③⑤ D.②③④⑤
6. 目前,科学界拟合成一种“双重结构”的球形分子,即把足球烯C60的分子容纳在Si60分子中,外面的硅原子与里面的碳原子以共价键结合,下列叙述错误的是
A. 该晶体属分子晶体 B. 该分子内原子间都以极性共价键相连接
C. 该物质是一种新化合物 D. 该物质的相对分子质量为2400
5.100℃时,将0.1molN2O4置于1L密闭的烧瓶中,然后将烧瓶放入100℃的恒温槽中,烧瓶内的气体逐渐变为红棕色:N2O4(g)
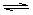 2NO2 (g)。下列结论不能说明上述反应在该条件下已经达到平衡状态的是
2NO2 (g)。下列结论不能说明上述反应在该条件下已经达到平衡状态的是
①烧瓶内气体的颜色不再加深,②N2O4 的消耗速率与NO2的生成速率之比为1∶2,③NO2的生成速率与NO2消耗速率相等,④NO2的物质的量浓度不变,⑤烧瓶内气体的质量不再变化,⑥烧瓶内气体的压强不再变化,⑦烧瓶内气体的密度不再变化,⑧烧瓶内气体平均相对分子质量不再变化
A.②⑤⑦ B.①③④⑥⑧ C.只有③ D.只有⑤
4.由一种阳离子与两种酸根离子组成的盐称为混盐。混盐CaOCl2中不同价态的氯在酸性条件下可以生成C12。下列关于混盐CaOCl 2 的说法不正确的是 A. CaOCl 2 与稀硫酸反应产生1mol Cl2 时转移2mol电子
B. CaOCl 2 的水溶液呈碱性
C. CaOCl 2 具有较强的氧化性
D. CaOCl 2 中氯元素的化合价为+1、-1.
3.下列叙述不正确的是
A.原子晶体中原子间平均距离越小,熔、沸点越高
B.在水溶液中能电离出自由移动的离子的晶体不一定是离子晶体
C.SnH4 、GeH4、SiH4、CH4四种物质的熔点依次降低
D.水加热到很高的温度都难以分解,是因为水分子之间存在着氢键
1.中学化学教材中有大量数据,下列为某同学利用教材中的数据所做的判断,其中不正确的是
A.用溶解度数据,可判断煮沸Mg(HCO3)2溶液所得产物是Mg(OH)2还是MgCO3
B.用沸点数据,可推测能否将一些液体混合物用分馏的方法分离开来的可能性
C.用反应热数据的大小,可判断不同反应的反应速率的快慢
D.用原子半径数据,可推断某些原子氧化性或还原性的强弱
 2.目前,脱氧保鲜剂已广泛应用于食品保鲜、粮食及药材防虫、防霉等领域。含铁脱氧剂是利用铁易氧化的性质,完全吸收包装袋中的氧,从而对包装袋内的物品起到防氧化的作用。当含铁脱氧剂变成红棕色时,脱氧剂失效。含铁脱氧剂的配方见右表。下列反应式中与铁脱氧原理无关的是
2.目前,脱氧保鲜剂已广泛应用于食品保鲜、粮食及药材防虫、防霉等领域。含铁脱氧剂是利用铁易氧化的性质,完全吸收包装袋中的氧,从而对包装袋内的物品起到防氧化的作用。当含铁脱氧剂变成红棕色时,脱氧剂失效。含铁脱氧剂的配方见右表。下列反应式中与铁脱氧原理无关的是

4.(★★★★★)使一定量锌与100 mL 18.5 mol·L-1浓H2SO4充分反应,锌完全溶解,同时生成标准状况下气体33.6 L。将反应后溶液稀释,测得其pH=1.0。
求:(1)生成气体的成分及体积(假设浓H2SO4与Zn反应还原产物只生成SO2);
(2)锌的质量;
(3)开始生成H2时H2SO4的浓度(假设溶液体积无变化)。
3. (★★★★)3.2 g 铜与过量硝酸(8 mol·L-1,30 ml)充分反应。硝酸的还原产物有NO2和NO,反应后溶液中所含H+为a mol,则此时溶液中所含NO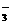 为________mol。
为________mol。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com