
题目列表(包括答案和解析)
20.(10分)请按要求填空
⑴ ⑵ ① ,
② 。
第II卷(共83分)
26.(12分)现有Fe、Cu组成的合金,其中Fe、Cu的总物质的量为a mol,Cu的物质的量分数为x;研成粉末后全部投入含b molHNO3的稀溶液中,微热使其充分反应,且硝酸的还原产物只有NO。试回答下列问题:
(1)用微粒符号填写下列空格(列举出全部可能的情况)
|
|
① |
② |
③ |
④ |
⑤ |
⑥ |
|
残留固体成分 |
|
|
|
|
|
|
|
溶液中的金属离子 |
|
|
|
|
|
|
(2)当溶液中金属离子只有Fe2+、Cu2+时,则b的取值范围是(用a、x表示) ;
(3)当x=0.5时,溶液中Fe3+与Fe2+的物质的量相等,在标准状况下共产生672mL 气体。求a、b的值。
高三化学模拟试题(二)答题卷 姓名 得分
第I卷(共67分)
25.(8分) (计算以下两小题时,除必须应用所给出的数据外,还各缺少一个数据,指出该数据的名称(分别以a和b表示缺少的数据),并列出计算式。
(1)在温度为t ℃和压强为p Pa的情况下,19.5 g A和11.0 g B恰好完全反应,生成固体C和3.00 L的D气体,计算生成C的质量(m)。
缺少的数据:___________________________。
计算式为m=___________________________。
(2)0.48 g金属镁与10 mL盐酸反应,生成的H2在标准状况下的体积V(H2) 。
缺少的数据:___________________________。
计算式为V(H2)=___________________________。
25.(12分)为扩大现有资源的使用效率,在一些油品中加入降凝剂J,以降低其凝固点,扩大燃料油品的使用范围。J是一种高分子聚合物,它的合成路线可以设计如下,其中A的氧化产物不发生银镜反应:
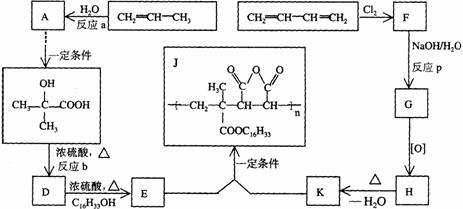
试写出:
(l)反应类型;a 、b 、P
(2)结构简式;F 、H
(3)化学方程式:D→E
E+K→J
24.(9分)现有A、B两种有机化合物,已知:
①它们的分子中含有相同数目的碳原子和氧原子,B可以看成A中一个氢原子被氨基取代得到;
②它们的分子中氢元素的质量分数相同,相对分子质量都不超过170,A中碳元素的质量分数为72.00%;
③它们都是一取代苯,分子中都没有甲基,都有一个羧基。
请按要求填空:
⑴A、B的分子中氢元素的质量分数都是___________;
⑵A的结构简式是________________________;
⑶A有一同分异构体C是对位二取代苯,能发生银镜反应也能与金属钠反应,但官能团不直接与苯环相连,C的结构简式是___________________;
⑷B有一同分异构体D是苯环上的一硝基化合物,其苯环和侧链上的一溴代物各有两种,D的结构简式是__________________________。
23.(12分)甲、乙、丙、丁四种单质在点燃的条件下反应生成X、Y、Z、
W四种化合物,转化关系如右图所示,又知: ①甲、乙、丙均为短周期元
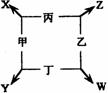 素的单质,常温下均为气态,丁是日常生活中的常见金属;②常温下,X是无
素的单质,常温下均为气态,丁是日常生活中的常见金属;②常温下,X是无
色液体,Y是黑色固体;
③丙在乙中燃烧发生苍白色火焰,丁在乙中燃烧生成棕色烟,W的水溶液呈黄色。请填空:
(1)丁在甲和X同时存在的条件下,容易被腐蚀,写出电极反应式:
负极:________________ 正极:_________________________________(2)将饱和W的溶液滴入到热的X中煮沸几分钟,反应的化学方程式为
______________________________________________________________。
(3)Y与足量的稀HNO3反应的离子方程式为:
_____________________________________________________________。
(4)在一定条件下,丁分别Y、Z反应生成等物质的量的丙时,消耗丁的物质的量之比为_______ ___。
22.(8分)有一瓶澄清溶液,其中可能含有NH4+、Na+、Mg2+、Al3+、Ba2+、Fe3+、SO42-、CO32-、Cl-和I-。取该溶液进行如下实验:
①用pH试纸检验,溶液呈强酸性
②取部分溶液,加入少量CCl4及数滴新制的氯水,振荡后静置,CCl4层呈紫红色
③另取部分溶液,逐滴加入稀氢氧化钠溶液,使溶液从酸性逐渐变为碱性,在滴加过程中及滴加完毕后,溶液中均无沉淀生成
④取上述碱性溶液,加入碳酸氢钠溶液,有白色沉淀生成
⑤将③得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝
根据上述实验事实确定:
(1)该溶液中肯定存在的离子有__________________。
(2)不能确定是否存在的离子有__________________。
(3)写出反应的离子方程式:
21.(12分)实验室用铜与稀硝酸制备NO,采用(1)装置不易观察到无色的NO生成;若用装置(Ⅱ),可达到满意的效果。
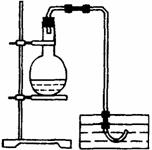 (Ⅰ)
(Ⅰ) 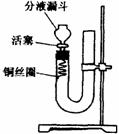 (Ⅱ)
(Ⅱ)
(1)将有关操作补充完全:
①将活塞打开,从U型管的长管口注入稀硝酸,一直注到 为止。
②关闭活塞,用酒精灯在 加热,当 时,立即撤去酒精灯。
(2)回答下列问题:
①反应在什么情况下可以自动停止
可在何处观察到无色的NO气体
②如果再将活塞慢慢打开,可立即观察到哪些明显现象
③如果要获得NO与NO2形成鲜明对照的实验效果,应该继续进行怎样的操作?
20.(10分)请按要求填空
⑴下列实验操作或对实验事实的叙述正确的是 (填序号)。
①向试管中滴加液体时,为不使液体滴到试管外应将胶头滴管伸入试管中;
②一小块金属钠加入水中后迅速熔成小球,不停地在水面游动并发出“吱吱”的响声;
 ③配置100mL1.00mol/L的NaCl溶液时,可用托盘天平称取5.85g NaCl固体;
③配置100mL1.00mol/L的NaCl溶液时,可用托盘天平称取5.85g NaCl固体;
④向可能含有SO42-、SO32-的溶液中加入过量的盐酸,再加入Ba(NO3)2溶液,可检验SO42-的存在;
⑤蒸发NaCl溶液以得到NaCl固体时,不必将溶液蒸干;
⑥向100℃时的NaOH稀溶液中滴加饱和的FeCl3溶液,以制备
Fe(OH)3胶体;
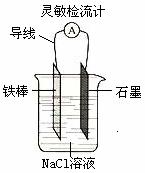
⑦如右图,可观察到灵敏检流计的指针偏转;
⑧向AlCl3溶液中滴加NaOH溶液和向NaOH溶液中滴加AlCl3溶
液的现象相同。


⑵ ①排除碱式滴定管中气泡的方法应
①排除碱式滴定管中气泡的方法应
采用操作 ,(填图编号)轻轻挤压玻璃球使尖嘴部分充满碱液。
甲 乙 丙
②向盛有50mL0.5mol/L盐酸的烧杯中迅速倒入50mL0.55mol/LNaOH溶液,溶液温度上升2. 5℃,则反应的热化学方程式为: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com