
题目列表(包括答案和解析)
11. 在一定温度下,有1mol N2气体和3mol H2气体发生下列反应:
N2(g)+3H2(g) 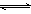 2NH3(g)
; △H<0
(1)若在相同温度下,分别在1L定压密闭容器中和1L定容容器中反应(密闭):
哪个容器中的反应先达到平衡? 答:
哪个容器中的N2的转化率高? 答:
(2)若在上述定压密闭容器中,反应已达到平衡时,再加入0.5摩氩气,则N2的转化率会起什么变化?正反应速度与原平衡相比,有无变化,简答理由。
(3)若在1升定容容器中,上述反应达到平衡时,平衡混和物中N2、H2、NH3的物质的量分别为A、B、C摩。仍维持原温度,用x、y、z分别表示开始时N2、H2、NH3的加入量(mol),使达到平衡后N2、H2、NH3的物质的量也为A、B、C摩。则应满足的条件是:
①若x=0,y=0,则z=
②若x=0.75,则y应为
mol、z应为
mol。
③x、y、z应满足的一般条件是
2NH3(g)
; △H<0
(1)若在相同温度下,分别在1L定压密闭容器中和1L定容容器中反应(密闭):
哪个容器中的反应先达到平衡? 答:
哪个容器中的N2的转化率高? 答:
(2)若在上述定压密闭容器中,反应已达到平衡时,再加入0.5摩氩气,则N2的转化率会起什么变化?正反应速度与原平衡相比,有无变化,简答理由。
(3)若在1升定容容器中,上述反应达到平衡时,平衡混和物中N2、H2、NH3的物质的量分别为A、B、C摩。仍维持原温度,用x、y、z分别表示开始时N2、H2、NH3的加入量(mol),使达到平衡后N2、H2、NH3的物质的量也为A、B、C摩。则应满足的条件是:
①若x=0,y=0,则z=
②若x=0.75,则y应为
mol、z应为
mol。
③x、y、z应满足的一般条件是
10.合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前常用醋酸二氨合铜(Ⅰ)溶液来吸收原料气中的CO,其反应式为:(Ac表示醋酸根) [Cu(NH3)2Ac]+CO+NH3 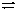 [Cu(NH3)3]Ac·CO;△H<0
(1) 必须除去原料气中CO的原因是
。
(2) 醋酸二氨合铜(Ⅰ)吸收CO的生产适宜条件应是
。
(3) 吸收CO后的醋酸铜氨溶液经过适当处理又可再生,恢复其吸收CO的能力以供循环使用。醋酸铜氨溶液再生的生产适宜条件是
。
[Cu(NH3)3]Ac·CO;△H<0
(1) 必须除去原料气中CO的原因是
。
(2) 醋酸二氨合铜(Ⅰ)吸收CO的生产适宜条件应是
。
(3) 吸收CO后的醋酸铜氨溶液经过适当处理又可再生,恢复其吸收CO的能力以供循环使用。醋酸铜氨溶液再生的生产适宜条件是
。
9.已知:C(s)+O2(g)===CO2(g);△H=-393.5KJ/mol
2 CO(g)+O2(g)===2CO2(g);△H=-567KJ/mol
写出C(s)+O2(g)→CO(g)的热化学方程式
8、(1)今年5月底6月初,各地报纸纷纷转载了不要将不同品牌洁污剂混合使用的警告,据报道,在全国各地发生了多起混合洁污剂发生氯气中毒的事件。根据你的化学知识作出如下判断(这一判断的正确性有待证明):当事人使用的液态洁污剂之一必定含有氯,最可能的存在形式是 和 。当另一种具有 (性质)的液态洁污剂与之混合,可能发生如下反应而产生氯气: (2)“神舟四号”模拟载人飞船于2002年12月30日在酒泉载人航天发射场发射升空,按预定轨道在太空环绕地球飞行107圈,于2003年1月5日在内蒙古地区对飞船进行了成功回收。回答下列问题: ①有一种火箭推进器中盛有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合反应时生成无污染的物质并放出大量的热,从而产生巨大的推动力。写出该反应的化学方程式: . ②在宇宙气飞船中,一般要安装盛有Na2O2颗粒的装置,用来提供氧气,若用KO2(超氧化钾)代替,效果更佳。写出在飞船舱内用生成氧气的化学方程式: ,该反应中氧化剂与还原剂的物质的量之比为 ,电子转移的数目为 。
7、在盛有淀粉NaI的溶液中,滴加少量的NaClO溶液,立即看到溶液变蓝,这是因为_________________的缘故,相应的反应方程式为_________________________________________________(提示:NaClO被还原成Cl2);在盛有淀粉和碘所形成的蓝色溶液中,滴加Na2SO3溶液时,又发现蓝色逐渐消失,这是因为________________________________________的缘故,相应的反应方程式为________________________________________。对比以上两组实验所得结果,得出NaClO、I2和Na2SO3的氧化性由强到弱的顺序是______________________________。
6.下图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是( )
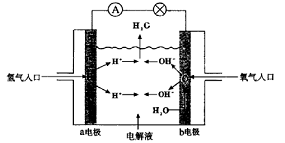
A.a电极是负极
B.b电极的电极反应为:4OH- - 4e-=2H2O+O2↑
C.氢氧燃料电池是一种具有应用前景的绿色电源
D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
4、在3Cl2+6KOH
 KClO3+5KCl+3H2O中,下列说法不正确的是
①Cl2是氧化剂,KOH是还原剂②KCl是还原产物,KClO3是氧化产物③反应中每3个Cl2分子中有5个电子转移④被氧化的氯原子是被还原氯原子物质的量的5倍⑤被还原的氯原子的物质的量是被氧化的氯原子的物质的量的5倍。
A.①④
B.③④ C.①⑤ D.②③
5、用下列方法均可制得氧气
(1)2KClO3
KClO3+5KCl+3H2O中,下列说法不正确的是
①Cl2是氧化剂,KOH是还原剂②KCl是还原产物,KClO3是氧化产物③反应中每3个Cl2分子中有5个电子转移④被氧化的氯原子是被还原氯原子物质的量的5倍⑤被还原的氯原子的物质的量是被氧化的氯原子的物质的量的5倍。
A.①④
B.③④ C.①⑤ D.②③
5、用下列方法均可制得氧气
(1)2KClO3
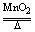 2KCl+3O2↑ (2)2Na2O2+2H2O=4NaOH+O2↑
(3)2HgO
2KCl+3O2↑ (2)2Na2O2+2H2O=4NaOH+O2↑
(3)2HgO 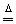 2Hg+O2↑ (4)2KMnO4
2Hg+O2↑ (4)2KMnO4 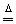 K2MnO4+MnO2+O2↑
若要制得相同质量的氧气,反应中电子转移数目之比为
A. 3:2:1:4 B. 1:1:1:1 C. 2:1:2:2
D. 1:2:1:1
K2MnO4+MnO2+O2↑
若要制得相同质量的氧气,反应中电子转移数目之比为
A. 3:2:1:4 B. 1:1:1:1 C. 2:1:2:2
D. 1:2:1:1
3.将50.00mL 0.098mol/L的羟氨(NH2OH)酸性溶液,与足量硫酸铁在煮沸条件下反应,生成的Fe2+又恰好被49.00mL0.040mol/L的酸性高锰酸钾溶液所氧化。在上述反应中,羟氨的氧化产物为( )
A.NO2 B.NO C.N2O D.N2
2.超导材料YBa2Cu3Ox中Y为+3价,Ba为+2价,Cu为+2、+3混合价态,其中+2价的Cu与+3价的Cu的物质的量之比为18∶7,则x的值为( )
A. 6.50 B. 6.92 C. 8.00 D. 8.05
1.向10mL 0.1mol/L的CuSO4溶液中加入10mL 0.15mol/L的NaOH溶液时,生成一种蓝色沉淀,溶液中的铜离子几乎沉淀完全,该蓝色沉淀的主要成分是 ( )
A.Cu(OH)2 B.Cu2(OH)2SO4
C.3Cu(OH)2·CuSO4 D.Cu2(OH)2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com