
题目列表(包括答案和解析)
1.(★★★)在一密闭容器中发生如下反应:
aA(g) bB(g)
bB(g)
达平衡后,保持温度不变,将容器容积增加一倍,新平衡建立时,cB 是原来的 60%,则( )
A.平衡向正反应方向发生了移动 B.A 物质的转化率变小了
C.B 物质的质量分数增大了 D.a>b
16.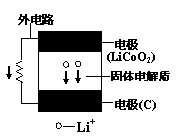 某新型二次锂离子电池结构如右图,电池内部是固体电解质,充电、放电时允许Li+在其间通过(图中电池内部“→”表示放电时Li+的迁移方向)。充电、放电时总反应可表示为:
某新型二次锂离子电池结构如右图,电池内部是固体电解质,充电、放电时允许Li+在其间通过(图中电池内部“→”表示放电时Li+的迁移方向)。充电、放电时总反应可表示为:
LiCoO2+6C  Li1-xCoO2+LixC6
Li1-xCoO2+LixC6
下列说法正确的是
A.外电路上的“→”,表示放电时的电流方向
B.充电时阴极电极反应:LixC6-xe-=6C+xLi+
C.放电时负极电极反应:LiCoO2-xe-=Li1-xCoO2+xLi+
D.外电路有0.1mole-通过,发生迁移的Li+的质量为0.7g
15.当向蓝色的CuSO4溶液中逐滴加入氨水时,观察到首先生成蓝色沉淀,而后沉淀又逐渐溶解成为深蓝色的溶液,向深蓝色溶液中通入SO2气体,又生成了白色沉淀:将白色沉淀加入稀硫酸中,又生成了红色粉末状固体和SO2气体,同时溶液呈蓝色(已知Cu2O在酸性环境中不能稳定存在)。根据上述实验现象分析推测,下列描述正确的有
A.Cu2+和Ag+相似,能与NH3结合生成铜氨络离子
B.白色沉淀为+2价铜的某种亚硫酸盐,溶于稀H2SO4发生复分解反应
C.白色沉淀为+1价铜的某种亚硫酸盐,在酸性条件下,只发生了氧化反应
D.反应过程中消耗的SO2与生成的SO2的物质的量相等
14.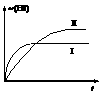 将1molH2(g)和2molI2(g)置于某2L密闭容器中,在一定温度下发生反应:H2(g)+I2(g)
将1molH2(g)和2molI2(g)置于某2L密闭容器中,在一定温度下发生反应:H2(g)+I2(g) 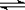 2HI(g);△H<0,并达到平衡,HI的体积分数ω(HI)随时间(t)变化如图(Ⅱ)所示。若改变反应条件,ω(HI)的变化如图(Ⅰ)所示,则改变的条件可能是
2HI(g);△H<0,并达到平衡,HI的体积分数ω(HI)随时间(t)变化如图(Ⅱ)所示。若改变反应条件,ω(HI)的变化如图(Ⅰ)所示,则改变的条件可能是
A.恒温恒容条件下,加入适当催化剂 B.恒容条件下升高温度
C.恒温条件下,缩小反应容器体积 D.恒温条件下,扩大反应容器体积
13.用体积相同、pH均为12的NaOH溶液和氨水,分别中和物质的量浓度相同的盐酸。当酸碱恰好完全反应时,NaOH溶液和氨水消耗盐酸的体积分别为V1和V2。则下列关系式正确的是
A.V1>V2 B.V1<V2 C.V1=V2 D.无法判断
12.下列反应的离子方程式书写正确的是
A.实验室用大理石与醋酸反应制取二氧化碳:CaCO3+2H+=Ca2++CO2↑+H2O
B.向过氧化钠固体中滴加水:Na2O2+H2O =2Na++2OH-+O2↑
C.硫酸亚铁溶于稀硝酸: 3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O
D.物质的量比为4∶3的NaHSO4和Ba(OH)2两溶液混合:4H++3SO42-+3Ba2++4OH-=3BaSO4↓+4H2O
11.丁香油酚结构简式如右图所示,下列关于它的性质说法正确的是
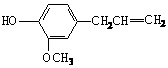 A.既可燃烧,又可使酸性KMnO4溶液褪色
A.既可燃烧,又可使酸性KMnO4溶液褪色
B.可跟NaHCO3溶液反应放出CO2气体
C.在碱性条件下可发生水解反应
D.可与浓溴水发生取代反应
10.已知25℃、101kPa条件下:4Al(s)+3O2(g) = 2Al2O3(s);△H = -2834.9kJ·mol-1
4Al(s)+2O3(g) = 2Al2O3(s);△H = -3119.1kJ·mol-1;由此得出的正确结论是
A.等质量的O2比O3能量低 B.O3比O2稳定,由O2变O3为吸热反应
C.等质量的O2比O2能量低 D.O2比O3稳定,由O2变O3为放热反应
9.设NA表示阿伏加德罗常数的值,下列叙述中正确的是
A.常温常压下,8.8g CO2和N2O混合物中所含有的原子数为0.6 NA
B.Cu和足量的稀硝酸反应产生4.48L气体时,转移的电子数为0.6 NA
C.标准状况下,3.36L丁烷中含有的非极性键数为0.6NA
D.在1L0.2mol/L的硫酸铁溶液中含有的硫酸根离子数为0.6 NA
8.下列除去括号内杂质的有关操作方法不正确的是:①苯(苯酚):加入NaOH溶液,分液;②乙醇(乙酸):加KOH溶液,分液;③苯(甲苯):加KMnO4/NaOH溶液,蒸馏;④乙烷(乙烯):酸性KMnO4溶液,洗气;⑤乙酸乙酯(乙酸):加入乙醇和浓硫酸,使乙酸全部转化为乙酸乙酯;⑥淀粉溶液(葡萄糖):渗析;⑦提取溶解在水中的少量碘:加入CCl4,分液,取出有机层再分离
A.①②④⑤ B.②③④⑤ C.②④⑤ D.④⑤⑥⑦
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com