
题目列表(包括答案和解析)
6、审题时还应特别注意以下几点:
(1)注意溶液的性质对离子间发生氧化还原反应的影响。如:Fe2+与NO3-能共存,但在强酸性条件下(即Fe2+、NO3-、H+相遇)不能共存;MnO4-与Cl-在强酸性条件下也不能共存;S2-与SO32-在钠、钾盐时可共存,但在酸性条件下则不能共存。
(2)弱酸盐的酸式根离子不能与强碱(OH-)、强酸(H+)共存。
如HCO3-+OH-=CO32-+H2O(HCO3-遇碱时进一步电离);HCO3-+H+=CO2↑+H2O
5、审题时应注意题中给出的附加条件。
①酸性溶液(H+)、碱性溶液(OH-)、能在加入铝粉后放出可燃气体的溶液、由水电离出的H+或OH-=1×10-10mol/L的溶液等。
②有色离子MnO4-,Fe3+,Fe2+,Cu2+,Fe(SCN)2+。 ③MnO4-,NO3-等在酸性条件下具有强氧化性。
③注意题目要求“大量共存”还是“不能大量共存”。
4.溶液中能发生络合反应的离子不能大量共存。
如Fe3+与SCN-不能大量共存;Fe3+与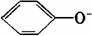 不能大量共存。
不能大量共存。
3.能水解的阳离子跟能水解的阴离子在水溶液中不能大量共存(双水解)。
例:Al3+和HCO3-、CO32-、HS-、S2-、AlO2-、ClO-等;Fe3+与CO32-、HCO3-、AlO2-、ClO-等不能大量共存。
2.由于发生氧化还原反应,离子不能大量共存。
(1)具有较强还原性的离子不能与具有较强氧化性的离子大量共存。如S2-、HS-、SO32-、I-和MnO4-、Fe3+不能大量共存。
(2)在酸性或碱性的介质中由于发生氧化还原反应而不能大量共存。SO32-和S2-在碱性条件下可以共存,但在酸性条件下则由于发生2S2-+SO32-+6H+=3S↓+3H2O反应不能共在。H+与S2O32-不能大量共存。
1.由于发生复分解反应,离子不能大量共存。
⑴有气体产生。如CO32-、SO32-、S2-、HCO3-、HSO3-、HS-等易挥发的弱酸的酸根与H+不能大量共存。
⑵有沉淀生成。如Ba2+、Ca2+、Mg2+、Ag+等不能与SO42-、CO32-等大量共存;Mg2+、Fe2+、Ag+、Al3+、Zn2+、Cu2+、Fe3+等不能与OH-大量共存;Pb2+与Cl-、Fe2+与S2-、Ca2+与PO43-、Ag+与Cl-、Br-、I-不能大量共存。
⑶有弱电解质生成。如OH-、CH3COO-、F-、ClO-、AlO2-、SiO32-、CN-、C17H35COO-、 等与H+不能大量共存;一些酸式弱酸根如HCO3-、HPO42-、HS-、H2PO4-、HSO3-既不能与OH-也不能与H+大量共存;NH4+与OH-不能大量共存。
等与H+不能大量共存;一些酸式弱酸根如HCO3-、HPO42-、HS-、H2PO4-、HSO3-既不能与OH-也不能与H+大量共存;NH4+与OH-不能大量共存。
⑷一些容易发生水解的离子,在溶液中的存在是有条件的。如: AlO2-、 S2-、CO32-、HCO3-、C6H5O-等必须在碱性条件下才能在溶液中存在;如Fe3+、Al3+等必须在酸性条件下才能在溶液中存在。
2.推论
(1)同温同压下,V1/V2=n1/n2 (2)同温同体积时,p1/p2=n1/n2=N1/N2
(3)同温同压等质量时,V1/V2=M2/M1 (4)同温同压同体积时,M1/M2=ρ1/ρ2
注意:
① 阿伏加德罗定律也适用于混合气体。
② 考查气体摩尔体积时,常用在标准状况下非气态的物质来迷惑考生,如H2O、SO3、已烷、辛烷、CHCl3等。
③物质结构和晶体结构:考查一定物质的量的物质中含有多少微粒(分子、原子、电子、质子、中子等)时常涉及稀有气体He、Ne等单原子分子,Cl2、N2、O2、H2双原子分子。胶体粒子及晶体结构:P4、金刚石、石墨、二氧化硅等结构。
1.内容:在同温同压下,同体积的气体含有相等的分子数。即“三同”定“一等”。
9、C 10、D 11、A 12、A 13、D 14、B 15、B 16、D 17、C 试题详解: 在氧化钠和过氧化钠中其阴、阳离子的个数比均为1∶2. 18、D 试题详解: 导解:酸性氧化物和非金属单质中有原子晶体,如SiO2,Si等;碱性氧化物一般为离子晶体;含氧酸为共价化合物,属于分子晶体. 19、A 试题详解: 导解:只有分子晶体才含有分子,也只有分子晶体的化学式能表示真实分子的组成. 20、C 试题详解: 导解:硫磺是分子晶体,但它不是化合物.
7、B 8、D
试题详解: 导解:A组为原子晶体,沸点高低由共价键的强弱决定,键长越短,键越强;B组为离子晶体,沸点高低由离子键的强弱决定,离子半径越小,离子键越强;C组由三种物质的状态即可判断:常温下SiO2为固体,CO2为气体,水为液体,所以SiO2>H2O>CO2;D组为分子晶体,沸点高低由分子间作用力的大小决定,结构相似的分子晶体,分子量越大,分子间作用力越大.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com