
题目列表(包括答案和解析)

A ↓(白)+ ↑(无色) (A:CaC2、Al2S3、Mg3N2)
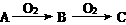 (A:S、H2S、N2、Na、醇)
(A:S、H2S、N2、Na、醇)
 (A:铵盐、Al、Si、CH3COONa)
(A:铵盐、Al、Si、CH3COONa)
 (A:氯化物)
(A:氯化物)
 (A:Al、(NH4)2CO3、NH4HCO3、NaHCO3、NaHS、(NH4)2S、NH4HS、氨基酸)
(A:Al、(NH4)2CO3、NH4HCO3、NaHCO3、NaHS、(NH4)2S、NH4HS、氨基酸)
中学化学常见气体单质:H2、O2、N2、Cl2、(F2)
固体单质:S、Na、Mg、Al、Fe、Cu
液体单质:Br2
中学化学常见化合物:NaCl、NaOH、Na2CO3、NaHCO3、FeCl2、FeCl3、H2SO4、
HCl、CaCO3、SO2、H2O、NO、NO2、HNO3
化学工业
|
制备的物质 |
反应原理 |
设备 |
|
O2 |
分离液态空气 |
|
|
CO2 |
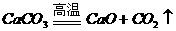 |
|
|
漂白粉和漂粉精 |
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O |
|
|
玻璃 |
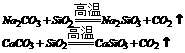 |
玻璃熔炉 |
|
合成氨 |
 |
合成塔 |
 |
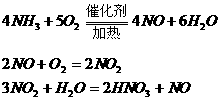 |
氧化炉、吸收塔 |
 |
 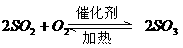  |
沸腾炉、接触室、吸收塔 |
|
炼铁 |
 |
高炉 |
|
氯碱工业 |
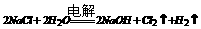 |
电解槽 |
|
炼铝 |
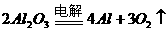 |
电解槽 |
|
精炼铜 |
阳极Cu-2e-=Cu2+、Zn-2e-=Zn2+、Fe-2e-=Fe2+ Ni-2e-=Ni2+ 阴极Cu2++2e-= Cu |
|
|
电镀铜 |
阳极Cu-2e-=Cu2+ 阴极Cu2++2e-= Cu |
|
Ⅲ、有机化学
最简式相同的有机物
1. CH:C2H2和C6H6
2. CH2:烯烃和环烷烃
3. CH2O:甲醛、乙酸、甲酸甲酯、葡萄糖
4. CnH2nO:饱和一元醛(或饱和一元酮)与二倍于其碳原子数和饱和一元羧酸或酯;举一例:乙醛(C2H4O)与丁酸及其异构体(C4H8O2)
同分异构体
1、醇--醚 CnH2n+2Ox
2、醛-酮-环氧烷(环醚) CnH2nO
3、羧酸-酯-羟基醛 CnH2nO2
4、氨基酸-硝基烷
能发生取代反应的物质及反应条件
1. 烷烃与卤素单质:卤素蒸汽、光照;
2. 苯及苯的同系物与①卤素单质:Fe作催化剂;
②浓硝酸:50-60℃水浴;浓硫酸作催化剂
③浓硫酸:70-80℃水浴;
3. 卤代烃水解:NaOH的水溶液;
4. 醇与氢卤酸的反应:新制的氢卤酸;
5. 酯类的水解:无机酸或碱催化;
6. 酚与浓溴水 (乙醇与浓硫酸在140℃时的脱水反应,事实上也是取代反应。)
能发生加成反应的物质
1. 烯烃的加成:卤素、H2、卤化氢、水
2. 炔烃的加成:卤素、H2、卤化氢
3. 苯及苯的同系物的加成:H2、Cl2
4. 苯乙烯的加成:H2、卤化氢、水、卤素单质
5. 不饱和烃的衍生物的加成:(包括卤代烯烃、卤代炔烃、烯醇、烯醛、烯酸、烯酸酯、烯酸盐等)
6. 含醛基的化合物的加成:H2、HCN等
7. 酮类物质的加成:H2
8. 油酸、油酸盐、油酸某酯、油(不饱和高级脂肪酸甘油酯)的加成。

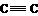 能与氢气加成的: 、C=C、 、C=O
能与氢气加成的: 、C=C、 、C=O
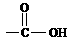

( 和 中的C=O双键不发生加成)

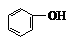
能与NaOH反应的:-COOH、 、 、
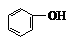 能与NaHCO3反应的:-COOH
能与NaHCO3反应的:-COOH
能与Na反应的:-COOH、 、-OH
能发生加聚反应的物质
烯烃、二烯烃、乙炔、苯乙烯、烯烃和二烯烃的衍生物。
能发生银镜反应的物质
凡是分子中有醛基(-CHO)的物质均能发生银镜反应。
1. 所有的醛(R-CHO);
2. 甲酸、甲酸盐、甲酸某酯;
注:能和新制Cu(OH)2反应的--除以上物质外,还有酸性较强的酸(如甲酸、乙酸、丙酸、盐酸、硫酸、氢氟酸等),发生中和反应。
能与溴水反应而使溴水褪色或变色的物质
(二)有机的:天然气(又叫沼气、坑气,主要成分为CH4)
液化石油气(以丙烷、丁烷为主) 裂解气(以CH2=CH2为主) 焦炉气(H2、CH4等)
电石气(CH≡CH,常含有H2S、PH3等)
具有漂白作用的物质
|
氧化作用 |
还原作用 |
吸附作用 |
|
Cl2、O3、Na2O2、浓HNO3 |
SO2 |
活性炭 |
|
化学变化 |
物理变化 |
|
|
不可逆 |
可逆 |
※其中能氧化指示剂而使指示剂褪色的主要有Cl2(HClO)和浓HNO3及Na2O2
能被活性炭吸附的物质
1、有毒气体(NO2、Cl2、NO等)--去毒;
2、色素--漂白;
3、水中有臭味的物质--净化。
能升华的物质
I2、干冰(固态CO2)、升华硫、红磷。
Fe3+的颜色变化
1、向FeCl3溶液中加几滴KSCN溶液呈红色;
2、FeCl3溶液与NaOH溶液反应,生成红褐色沉淀;
3、向FeCl3溶液溶液中通入H2S气体,生成淡黄色沉淀;
4、向FeCl3溶液中加入过量Fe粉时,溶液变浅绿色;
5、向FeCl3溶液中加入过量Cu粉,溶液变蓝绿色;
6、将FeCl3溶液滴入淀粉KI溶液中,溶液变蓝色;
7、向FeCl3溶液中滴入苯酚溶液,溶液变紫色
“置换反应”有哪些?
1、较活泼金属单质与不活泼金属阳离子间置换
如:Zn+Cu2+==Zn2++Cu Cu+2Ag+=2Ag+Cu2+
2、活泼非金属单质与不活泼非金属阴离子间置换
Cl2+2Br‾==2Cl‾+Br2 I2+S2−==2I‾+S 2F2+2H2O==4HF+O2
3、活泼金属与弱氧化性酸中H+置换
2Al+6H+==2Al3−+3H2↑ Zn+2CH3COOH==Zn2++2CH3COO‾+H2↑
4、金属单质与其它化合物间置换
2Mg+CO22MgO+C 2Mg+SO22 MgO+S
2Na+2H2O==2Na++2OH‾+H2↑ 2Na+2C2H5OH→2C2H5ONa+H2↑
10Al+3V2O55Al2O3+6V 8Al+3Fe3O44 Al2O3+9Fe
2FeBr2+3Cl2==2FeCl3+2Br2 2 FeI2+3Br2==2FeBr3+2I2
Mg+2H2OMg(OH)2+H2↑ 3Fe+4H2O(气)Fe3O4+4 H2↑
5、非金属单质与其它化合物间置换
H2S+X2==S↓+2H++2X‾ 2H2S+O2(不足)2S+2H2O
CuO+CCu+CO↑ CuO+H2Cu+H2O SiO2+2CSi+2CO↑
3Cl2+8NH3==6NH4Cl+N2 3Cl2+2NH3==6HCl+N2
条件不同,生成物则不同
1、2P+3Cl22PCl3(Cl2不足) ;2P+5Cl22 PCl5(Cl2充足)
2、2H2S+3O22H2O+2SO2(O2充足) ;2H2S+O22H2O+2S(O2不充足)
3、4Na+O22Na2O 2Na+O2Na2O2
4、Ca(OH)2+CO2CaCO3↓+H2O ;Ca(OH)2+2CO2(过量)==Ca(HCO3)2↓
5、C+O2CO2(O2充足) ;2 C+O22CO (O2不充足)
6、8HNO3(稀)+3Cu==2NO↑+2Cu(NO3)2+4H2O
4HNO3(浓)+Cu==2NO2↑+Cu(NO3)2+2H2O
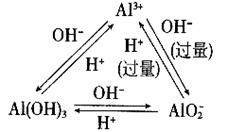
7、AlCl3+3NaOH==Al(OH)3↓+3NaCl ;
AlCl3+4NaOH(过量)==NaAlO2+2H2O
8、NaAlO2+4HCl(过量)==NaCl+2H2O+AlCl3
NaAlO2+HCl+H2O==NaCl+Al(OH)3↓
9、Fe+6HNO3(热、浓)==Fe(NO3)3+3NO2↑+3H2O
Fe+HNO3(冷、浓)→(钝化)
10、Fe+6HNO3(热、浓)Fe(NO3)3+3NO2↑+3H2O
Fe+4HNO3(热、浓)Fe(NO3)2+2NO2↑+2H2O
11、Fe+4HNO3(稀)Fe(NO3)3+NO↑+2H2O
|
|
 CH2=CH2↑+H2O
CH2=CH2↑+H2O
|
|
 C2H5-O-C2H5+H2O
C2H5-O-C2H5+H2O
13、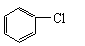
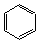 +Cl2 +HCl
+Cl2 +HCl
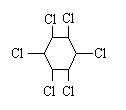
 +3Cl2 (六氯环已烷)
+3Cl2 (六氯环已烷)
14、C2H5Cl+NaOH C2H5OH+NaCl C2H5Cl+NaOHCH2=CH2↑+NaCl+H2O
15、6FeBr2+3Cl2(不足)==4FeBr3+2FeCl3 2FeBr2+3Cl2(过量)==2Br2+2FeCl3
滴加顺序不同,现象不同
1、AgNO3与NH3·H2O:
AgNO3向NH3·H2O中滴加--开始无白色沉淀,后产生白色沉淀
NH3·H2O向AgNO3中滴加--开始有白色沉淀,后白色沉淀消失
2、NaOH与AlCl3:
NaOH向AlCl3中滴加--开始有白色沉淀,后白色沉淀消失
AlCl3向NaOH中滴加--开始无白色沉淀,后产生白色沉淀
3、HCl与NaAlO2:
HCl向NaAlO2中滴加--开始有白色沉淀,后白色沉淀消失
NaAlO2向HCl中滴加--开始无白色沉淀,后产生白色沉淀
4、Na2CO3与盐酸:
Na2CO3向盐酸中滴加--开始有气泡,后不产生气泡
盐酸向Na2CO3中滴加--开始无气泡,后产生气泡
几个很有必要熟记的相等式量
 Ar CaCO3 Fe
CuO
Ar
Ar CaCO3 Fe
CuO
Ar
20 100 KHCO3 56 CaO 80 SO3 Ca
HF Mg3N2 KOH Br 40 MgO
NaOH

 N2 H2SO4 NH4NO3 SO2
CuSO4
N2 H2SO4 NH4NO3 SO2
CuSO4
28 98 44 CO2 64 160 Fe2O3
CO H3PO4 N2O Cu Br2
1.常用相对分子质量
Na2O2:78 Na2CO3:106 NaHCO3:84 Na2SO4:142
BaSO4:233 Al (OH)3:78 C6H12O6:180
2.常用换算
5.6L--0.25 mol 2.8L--0.125 mol 15.68L--0.7 mol
 20.16L--0.9 mol
16.8L--0.75 mol
20.16L--0.9 mol
16.8L--0.75 mol
3.常用反应
Al3+ + 4OH- = AlO2- +2H2O
3AlO2- + Al3+ + 6H2O = 4 Al (OH)3
2CO2 + 2Na2O2 = 2Na2CO3 + O2 △m = 56g
2H2O + 2Na2O2 = 4NaOH + O2 △m = 4g
AlO2- + CO2 + 2H2O = Al (OH)3↓+ HCO3-
4.特殊反应
2F2 + 2H2O = 4HF + O2
2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑
(一)无机的:爆鸣气(H2与O2); 水煤气或煤气(CO与H2);碳酸气(CO2)
(二)混合物:氨水(分子:NH3、H2O、NH3·H2O;离子:NH4+、OH‾、H+)
氯水(分子:Cl2、H2O、HClO;离子:H+、Cl‾、ClO‾、OH‾)
苏打水(Na2CO3的溶液) 生理盐水(0.9%的NaCl溶液)
水玻璃(Na2SiO3水溶液) 卤水(MgCl2、NaCl及少量MgSO4)
水泥(2CaO·SiO2、3CaO·SiO2、3CaO·Al2O3) 王水(由浓HNO3和浓盐酸以1∶3的体积比配制成的混合物)
2、各种“气”汇集
(一)纯净物:重水D2O;超重水T2O;蒸馏水H2O;双氧水H2O2;水银Hg; 水晶SiO2。
(二)“18电子”的微粒
|
|
分子 |
离子 |
|
一核18电子的 |
Ar |
K+、Ca2+、Cl‾、S2− |
|
二核18电子的 |
F2、HCl |
HS− |
|
三核18电子的 |
H2S |
|
|
四核18电子的 |
PH3、H2O2 |
|
|
五核18电子的 |
SiH4、CH3F |
|
|
六核18电子的 |
N2H4、CH3OH |
|
注:其它诸如C2H6、N2H5+、N2H62+等亦为18电子的微粒。
微粒半径的比较:
1、判断的依据 电子层数: 相同条件下,电子层越多,半径越大。
核电荷数 相同条件下,核电荷数越多,半径越小。
最外层电子数 相同条件下,最外层电子数越多,半径越大。
2、具体规律:1、同周期元素的原子半径随核电荷数的增大而减小(稀有气体除外)如:Na>Mg>Al>Si>P>S>Cl.
2、同主族元素的原子半径随核电荷数的增大而增大。如:Li<Na<K<Rb<Cs
3、同主族元素的离子半径随核电荷数的增大而增大。如:F--<Cl--<Br--<I--
4、电子层结构相同的离子半径随核电荷数的增大而减小。如:F-> Na+>Mg2+>Al3+
5、同一元素不同价态的微粒半径,价态越高离子半径越小。如Fe>Fe2+>Fe3+
物质熔沸点的比较
(1)不同类晶体:一般情况下,原子晶体>离子晶体>分子晶体
(2)同种类型晶体:构成晶体质点间的作用大,则熔沸点高,反之则小。
①离子晶体:离子所带的电荷数越高,离子半径越小,则其熔沸点就越高。
②分子晶体:对于同类分子晶体,式量越大,则熔沸点越高。HF、H2O、NH3等物质分子间存在氢键。
③原子晶体:键长越小、键能越大,则熔沸点越高。
(3)常温常压下状态
①熔点:固态物质>液态物质
②沸点:液态物质>气态物质
 定义:把分子聚集在一起的作用力
定义:把分子聚集在一起的作用力
 分子间作用力(范德瓦尔斯力):影响因素:大小与相对分子质量有关。
分子间作用力(范德瓦尔斯力):影响因素:大小与相对分子质量有关。
作用:对物质的熔点、沸点等有影响。
 ①、定义:分子之间的一种比较强的相互作用。
①、定义:分子之间的一种比较强的相互作用。
分子间相互作用 ②、形成条件:第二周期的吸引电子能力强的N、O、F与H之间(NH3、H2O)
③、对物质性质的影响:使物质熔沸点升高。
④、氢键的形成及表示方式:F--H···F--H···F--H···←代表氢键。



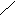 氢键
O
O
氢键
O
O

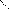 H
H
H H
H
H
H H

 O
O
H H
⑤、说明:氢键是一种分子间静电作用;它比化学键弱得多,但比分子间作用力稍强;是一种较强的分子间作用力。
 定义:从整个分子看,分子里电荷分布是对称的(正负电荷中心能重合)的分子。
定义:从整个分子看,分子里电荷分布是对称的(正负电荷中心能重合)的分子。
 非极性分子 双原子分子:只含非极性键的双原子分子如:O2、H2、Cl2等。
非极性分子 双原子分子:只含非极性键的双原子分子如:O2、H2、Cl2等。
 举例:
只含非极性键的多原子分子如:O3、P4等
举例:
只含非极性键的多原子分子如:O3、P4等
分子极性 多原子分子: 含极性键的多原子分子若几何结构对称则为非极性分子
如:CO2、CS2(直线型)、CH4、CCl4(正四面体型)
 极性分子: 定义:从整个分子看,分子里电荷分布是不对称的(正负电荷中心不能重合)的。
极性分子: 定义:从整个分子看,分子里电荷分布是不对称的(正负电荷中心不能重合)的。
 举例 双原子分子:含极性键的双原子分子如:HCl、NO、CO等
举例 双原子分子:含极性键的双原子分子如:HCl、NO、CO等
 多原子分子: 含极性键的多原子分子若几何结构不对称则为极性分子
多原子分子: 含极性键的多原子分子若几何结构不对称则为极性分子
如:NH3(三角锥型)、H2O(折线型或V型)、H2O2
 定义:在化学反应过程中放出或吸收的热量;
定义:在化学反应过程中放出或吸收的热量;
符号:△H
单位:一般采用KJ·mol-1
测量:可用量热计测量
研究对象:一定压强下在敞开容器中发生的反应所放出或吸收的热量。
 反应热: 表示方法:放热反应△H<0,用“-”表示;吸热反应△H>0,用“+”表示。
反应热: 表示方法:放热反应△H<0,用“-”表示;吸热反应△H>0,用“+”表示。
燃烧热:在101KPa下,1mol物质完全燃烧生成稳定氧化物时所放出的热量。
 定义:在稀溶液中,酸跟碱发生反应生成1molH2O时的反应热。
定义:在稀溶液中,酸跟碱发生反应生成1molH2O时的反应热。
中和热:强酸和强碱反应的中和热:H+(aq)+OH-(aq)=H2O(l); △H=-57.3KJ·mol-
弱酸弱碱电离要消耗能量,中和热 |△H|<57.3KJ·mol-1
 原理:断键吸热,成键放热。
原理:断键吸热,成键放热。
 反应热的微观解释:反应热=生成物分子形成时释放的总能量-反应物分子断裂时所吸收的总能量
反应热的微观解释:反应热=生成物分子形成时释放的总能量-反应物分子断裂时所吸收的总能量
 定义:表明所放出或吸收热量的化学方程式。
定义:表明所放出或吸收热量的化学方程式。
意义:既表明化学反应中的物质变化,也表明了化学反应中的能量变化。
 热化学
①、要注明反应的温度和压强,若反应是在298K,1atm可不注明;
热化学
①、要注明反应的温度和压强,若反应是在298K,1atm可不注明;
方程式 ②、要注明反应物和生成物的聚集状态或晶型;
书写方法 ③、△H与方程式计量数有关,注意方程式与△H对应,△H以KJ·mol-1单位,化学计量数可以是整数或分数。
④、在所写化学反应方程式后写下△H的“+”或“-”数值和单位,方程式与△H之间用“;”分开。
盖斯定律:一定条件下,某化学反应无论是一步完成还是分几步完成,反应的总热效应相同。
影响化学反应速率的因素及其影响结果
内因:反应物的性质
外因 浓度↗ v↗ 压强↗ v↗(气体)
温度↗ v↗ 催化剂 v↗(正催化剂)
其它(光,超声波,激光,放射线,电磁波,反应物颗粒大小,扩散速率,溶剂等)
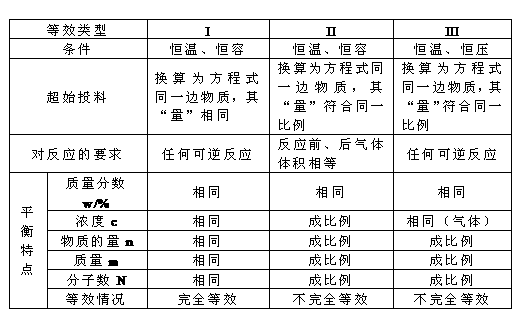
影响化学平衡的的条件:
(1)浓度:在其它条件不变的情况下,增大反应物的浓度或减小生成物的浓度,平衡向正反应方向移动;反之向逆反应方向移动;
(2)压强:在其它条件不变的情况下,增大压强会使平衡向气体体积缩小的方向移动;减小压强平衡向气体体积增大的方向移动;注意:①对于气体体积相同的反应来说,增减压强平衡不移动; ②若平衡混合物都是固体或液体,增减压强平衡也不移动; ③压强变化必须改变了浓度才有可能使平衡移动.
3)温度:在其它条件不变时,升高温度平衡向吸热方向移动;降低温度平衡向放热方向移动.(温度改变时,平衡一般都要移动)注意:催化剂同等倍数加快或减慢正逆反应的速率,故加入催化剂不影响平衡,但可缩短达到平衡的时间.
勒沙特列原理(平衡移动原理)
如果改变影响平衡的一个条件(浓度,温度,压强等)平衡就向减弱这种改变的方向移动.
充入稀有气体对化学平衡的影响:
(1)恒压下通稀有气体,平衡移动方向相当于直接减压(也同于稀释对溶液中反应的影响);
(2)恒容下通稀有气体,平衡不移动. 注意:只要与平衡混合物的物质不反应的气体都可称”稀有”气体
Ⅱ、元素及其化合物
1、各种“水”汇集
(一)“10电子”的微粒:
|
|
分子 |
离子 |
|
一核10电子的 |
Ne |
N3−、O2−、F−、Na+、Mg2+、Al3+ |
|
二核10电子的 |
HF |
OH−、 |
|
三核10电子的 |
H2O |
NH2− |
|
四核10电子的 |
NH3 |
H3O+ |
|
五核10电子的 |
CH4 |
NH4+ |
(1)常见金属活动性顺序表(联系放电顺序)
K,Ca,Na,Mg,Al,Zn,Fe,Sn,Pb(H),Cu,Hg,Ag,Pt,Au(还原能力-失电子能力减弱)

 K+,Ca2+,Na+,Mg2+,Al3+,Zn2+,Fe2+,Sn2+,Pb2+
(H+),Cu2+,Hg2+,Ag+(氧化能力-得电子能力增强)
K+,Ca2+,Na+,Mg2+,Al3+,Zn2+,Fe2+,Sn2+,Pb2+
(H+),Cu2+,Hg2+,Ag+(氧化能力-得电子能力增强)
(2)非金属活动顺序表
 F O Cl Br I S(氧化能力减弱)
F O Cl Br I S(氧化能力减弱)
 F- Cl- Br- I- S2-(还原能力增强)
F- Cl- Br- I- S2-(还原能力增强)
比较金属性强弱的依据
金属性:金属气态原子失去电子能力的性质;
金属活动性:水溶液中,金属原子失去电子能力的性质。
注:金属性与金属活动性并非同一概念,两者有时表现为不一致,
1、同周期中,从左向右,随着核电荷数的增加,金属性减弱;
同主族中,由上到下,随着核电荷数的增加,金属性增强;
2、依据最高价氧化物的水化物碱性的强弱;碱性愈强,其元素的金属性也愈强;
3、依据金属活动性顺序表(极少数例外);
4、常温下与酸反应剧烈程度;5、常温下与水反应的剧烈程度;
6、与盐溶液之间的置换反应;7、高温下与金属氧化物间的置换反应。
比较非金属性强弱的依据
1、同周期中,从左到右,随核电荷数的增加,非金属性增强;
同主族中,由上到下,随核电荷数的增加,非金属性减弱;
2、依据最高价氧化物的水化物酸性的强弱:酸性愈强,其元素的非金属性也愈强;
3、依据其气态氢化物的稳定性:稳定性愈强,非金属性愈强;
4、与氢气化合的条件;
5、与盐溶液之间的置换反应;
6、其他,例:2Cu+SCu2S Cu+Cl2CuCl2 所以,Cl的非金属性强于S。
“10电子”、“18电子”的微粒小结
(1)根据元素的化合价
 物质中元素具有最高价,该元素只有氧化性;物质中元素具有最低价,该元素只有还原性;物质中元素具有中间价,该元素既有氧化性又有还原性。对于同一种元素,价态越高,其氧化性就越强;价态越低,其还原性就越强。
物质中元素具有最高价,该元素只有氧化性;物质中元素具有最低价,该元素只有还原性;物质中元素具有中间价,该元素既有氧化性又有还原性。对于同一种元素,价态越高,其氧化性就越强;价态越低,其还原性就越强。
(2)根据氧化还原反应方程式
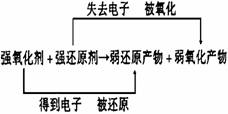
在同一氧化还原反应中,氧化性:氧化剂>氧化产物
还原性:还原剂>还原产物
氧化剂的氧化性越强,则其对应的还原产物的还原性就越弱;还原剂的还原性越强,则其对应的氧化产物的氧化性就越弱。
(3)根据反应的难易程度
注意:①氧化还原性的强弱只与该原子得失电子的难易程度有关,而与得失电子数目的多少无关。得电子能力越强,其氧化性就越强;失电子能力越强,其还原性就越强。
②同一元素相邻价态间不发生氧化还原反应。
③难得电子得物质不一定难失电子,难失电子的也不一定难得电子(如He、Ne等既难得电子也难失电子)
常见氧化剂:
①、活泼的非金属,如Cl2、Br2、O2 等;
②、元素(如Mn等)处于高化合价的氧化物,如MnO2等
③、元素(如S、N等)处于高化合价时的含氧酸,如浓H2SO4、HNO3 等
④、元素(如Mn、Cl、Fe等)处于高化合价时的盐,如KMnO4、KClO3、FeCl3、K2Cr2O7
⑤、过氧化物,如Na2O2、H2O2等。
常见还原剂
①、活泼的金属,如Na、Al、Zn、Fe 等;
②、元素(如C、S等)处于低化合价的氧化物,如CO、SO2等
③、元素(如Cl、S等)处于低化合价时的酸,如浓HCl、H2S等
④、元素(如S、Fe等)处于低化合价时的盐,如Na2SO3、FeSO4等
⑤、某些非金属单质,如H2 、C、Si等。
(1)合事实:离子反应要符合客观事实,不可臆造产物及反应。
(2)式正确:化学式与离子符号使用正确合理。
(3)号实际:“=”“ ”“→”“↑”“↓”等符号符合实际。
”“→”“↑”“↓”等符号符合实际。
(4)两守恒:两边原子数、电荷数必须守恒(氧化还原反应离子方程式中氧化剂得电子总数与还原剂失电子总数要相等)。
(5)明类型:分清类型,注意少量、过量等。
(6)检查细:结合书写离子方程式过程中易出现的错误,细心检查。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com