
题目列表(包括答案和解析)
2.(★★★★)向下列一定浓度溶液中滴入氢氧化铁胶体,没有红褐色沉淀产生,继续滴入氢氧化铁胶体,产生红褐色沉淀的是( )
A.H2SO4 B.Na2SO4 C.HCl D.C2H5OH
1.(★★★)向下列溶液中滴入稀硫酸,生成白色沉淀,继续滴入稀硫酸,沉淀又溶解的是( )
A.Na2SiO3 B.BaCl2 C.FeCl3 D.NaAlO2
(三) 溶液计算
1.基本公式及关系:
 (1)物质的量浓度:
(1)物质的量浓度:
①
②稀释过程中溶质不变:C1V1=C2V2。
③同溶质的稀溶液相互混合:C混=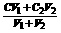
④质量分数换算为物质的量浓度:C=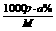
(2)溶质的质量分数。
①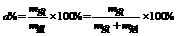
②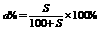 (饱和溶液,S代表溶质该条件下的溶解度)
(饱和溶液,S代表溶质该条件下的溶解度)
③混合:m1a1%+m2a2%=(m1+m2)a%混
④稀释:m1a1%=m2a2%
(3)有关溶解度的计算:
①S=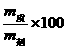 (饱和溶液:一定温度下)
(饱和溶液:一定温度下)
②S=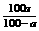 (a%:饱和溶液质量分数)
(a%:饱和溶液质量分数)
③有关pH值的计算:酸算H+,碱算OH-
Ⅰ. pH= -lg[H+]
Ⅱ. KW=[H+][OH-]=10-14(25℃下)
(一)有关化学式的计算
1.通过化学式,根据组成物质的各元素的原子量,直接计算分子量。
2.已知标准状况下气体的密度,求气体的式量:M=22.4ρ。
3.根据相对密度求式量:M=MˊD。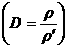
4.混合物的平均分子量:
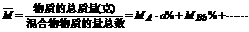
5.相对原子质量
①原子的相对原子质量=
②质量数=质子数+中子数
③元素相对原子质量: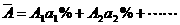
A1、A2表示同位素相对原子质量,a1%、a2%表示原子的摩尔分数
④元素近似相对原子质量: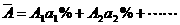
A1、A2表示同位素相对原子质量,a1%、a2%表示原子的摩尔分数
②对气体使用体积时注意条件(温度及压强),否则气体体积无意义
Ⅴ、化学计算
酯的水解(70-80℃)、硝酸钾溶解度的测定(室温-100℃)需用温度计来控制温度;银镜反应需用温水浴加热即可。
(二)无机
1. -2价硫的化合物(H2S、氢硫酸、硫化物);
2. +4价硫的化合物(SO2、H2SO3及亚硫酸盐);
3. 双氧水(H2O2,其中氧为-1价)
Ⅳ、化学实验:
不宜长期暴露空气中的物质
1.由于空气中CO2的作用:
生石灰、NaOH、Ca(OH)2溶液、Ba(OH)2溶液、NaAlO2溶液、水玻璃、碱石灰、漂白粉、苯酚钠溶液、Na2O、Na2O2;
2.由于空气中H2O的作用:
浓H2SO4、P2O5、硅胶、CaCl2、碱石灰等干燥剂、浓H3PO4、无水硫酸铜、CaC2、NaOH固体、生石灰;
3.由于空气中O2的氧化作用:
钠、钾、白磷和红磷、NO、天然橡胶、苯酚、-2价硫(氢硫酸或硫化物水溶液)、+4价硫(SO2水溶液或亚硫酸盐)、亚铁盐溶液、Fe(OH)2。
4.由于挥发或自身分解作用:
AgNO3、浓HNO3、H2O2、液溴、浓氨水、浓HCl、Cu(OH)2。
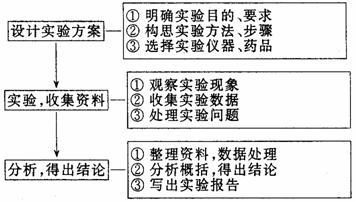 化学实验设计思维模型:
化学实验设计思维模型:
实验中水的妙用
(一)有机
1. 不饱和烃(烯烃、炔烃、二烯烃、苯乙烯等);
2. 苯的同系物;
3. 不饱和烃的衍生物(烯醇、烯醛、烯酸、卤代烃、油酸、油酸盐、油酸酯等);
4. 含醛基的有机物(醛、甲酸、甲酸盐、甲酸某酯等);
5. 石油产品(裂解气、裂化气、裂化汽油等);
6. 煤产品(煤焦油);
7. 天然橡胶(聚异戊二烯)。
(二)无机
1. -2价硫(H2S及硫化物);
2. +4价硫(SO2、H2SO3及亚硫酸盐);
3. +2价铁:
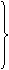 6FeSO4+3Br2=2Fe2(SO4)3+2FeBr3
6FeSO4+3Br2=2Fe2(SO4)3+2FeBr3
6FeCl2+3Br2=4FeCl3+2FeBr3 变色
2FeI2+3Br2=2FeBr3+2I2
4.Zn、Mg等单质 如Mg+Br2MgBr2
(此外,其中亦有Mg与H+、Mg与HBrO的反应)
5.-1价的碘(氢碘酸及碘化物) 变色
6.NaOH等强碱:Br2+2OH‾==Br‾+BrO‾+H2O
7.AgNO3
能萃取溴而使溴水褪色的物质
上层变无色的(ρ>1):卤代烃(CCl4、氯仿、溴苯等)、CS2;
下层变无色的(ρ<1):直馏汽油、煤焦油、苯及苯的同系物、液态环烷烃、低级酯、液态饱和烃(如已烷等)等
能使酸性高锰酸钾溶液褪色的物质
(一)有机
1. 不饱和烃(烯烃、炔烃、二烯烃、苯乙烯等);
2. 不饱和烃的衍生物(烯醇、烯醛、油酸、油酸盐、油酸某酯、油等)
3. 石油产品(裂化气、裂解气、裂化汽油等);
4. 苯酚及其同系物(因为能与溴水取代而生成三溴酚类沉淀)
5. 含醛基的化合物
6. 天然橡胶(聚异戊二烯)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com