
题目列表(包括答案和解析)
4.常温时,将V1 mL c1 mol·L-1的醋酸滴加到V2 mL c2 mol·L-1的烧碱溶液中,下列结论正确的是
A.若V1 = V2,且混合溶液pH < 7,则有c1 < c2
B.若V1 = V2,c1 = c2,则混合溶液中c (Na+) = c (CH3COO-)
C.若混合溶液的pH = 7,则有c1 V1 >c2 V2
D.若混合溶液的pH = 7,则混合溶液中c (Na+) > c (CH3COO-)
3.t℃时,将一定量A的不饱和溶液均分为三份,分别加热蒸发,然后冷却至t ℃,已知三份溶液分别蒸发水的质量为10g、20g、30g,析出A晶体(不含结晶水)的质量依次为ag、bg、cg,则a、b、c三者的关系为
A.c = a + b B.c = 2 b-a C.c = a + 2 b D.c = 2 a-b
2. 对于2 SO2 (g) + O2 (g) 2 SO3 (g) ;ΔH< 0,工业生产采用的下列措施中,不是从提高化学反应速率或SO2转化率的因素考虑的为
对于2 SO2 (g) + O2 (g) 2 SO3 (g) ;ΔH< 0,工业生产采用的下列措施中,不是从提高化学反应速率或SO2转化率的因素考虑的为
A.使用V2O5做催化剂 B.接触室中不使用很高的温度
C.用过量的空气跟SO2反应 D.接触氧化在常压下进行
1.下列分子中所有原子都满足最外层为8电子结构的是
A.BF3 B.H2O C.SiCl4 D.PCl5
4.(★★★★★)(1)中学教材上图示了NaCl晶体结构,它向三维空间延伸得到完美晶体。NiO(氧化镍)晶体的结构与NaCl相同,Ni2+与最近O2-的核间距离为a×10-8cm,计算NiO晶体的密度(已知NiO摩尔质量为74.7 g·mol-1)。

图1-1
(2)天然的和绝大部分人工制备的晶体,都存在各种缺陷,例如在某种NiO晶体中就存在如图1-1所示的缺陷:一个Ni2+空缺,另有两个Ni2+被两个Ni3+所取代。其结果晶体仍呈电中性,但化合物中Ni和O的比值却发生了变化。某氧化镍样品组成为Ni0.97O,试计算该晶体中Ni3+与Ni2+的离子数之比。
3.(★★★★)A、B、C三种物质各15 g,发生如下反应:
A+B+C D
D
反应后生成D的质量为30 g。然后在残留物中加入10 g A,反应又继续进行,待反应再次停止,反应物中只剩余C,则下列说法正确的是( )
A.第一次反应停止时,剩余B 9 g
B.第一次反应停止时,剩余C 6 g
C.反应中A和C的质量比是5∶3
D.第二次反应后,C剩余5 g
2.(★★★)某露置的苛性钾经分析含水:7.62%(质量分数,下同)、K2CO3:2.38%、KOH :90.00%。取此样品 1.00 g 放入 46.00 mL 1.00 mol·L-1 的 HCl(aq) 中,过量的 HCl 可用 1.070 mol/L KOH(aq)中和至中性,蒸发中和后的溶液可得固体_______克。
1.(★★★)将
3.48 g Fe3O4 完全溶解在
100 mL 1.00 mol/L 的 H2SO4(aq)
中,然后加入 K2Cr2O7(aq)25.00 mL,恰好使 Fe2+全部转化为 Fe3+,且 Cr2O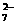 全部转化为 Cr3+。则
K2Cr2O7 的物质的量浓度为__________。
全部转化为 Cr3+。则
K2Cr2O7 的物质的量浓度为__________。
4.质量守恒
包含两项内容:①质量守恒定律;②化学反应前后某原子(或原子团)的质量不变。
此外,还有物料平衡,将编排在第16篇--水的电离中。
●歼灭难点训练
3.原子守恒
系列反应中某原子(或原子团)个数(或物质的量)不变。以此为基础可求出与该原子(或原子团)相关连的某些物质的数量(如质量)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com