
题目列表(包括答案和解析)
2.下列各组元素中原子半径依次增大的是
A. C、 N 、F B.Na、 Mg、 Al C. C、N 、 P D. Cl 、Br、 I
1.下列元素中非金属性最强的是
A. H B. He C. F D. O
10. (共15分)
(1)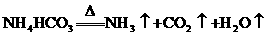 (2分)
(2分)
(2)碱石灰(1分);无水 只能吸水,不能吸收CO2或
只能吸水,不能吸收CO2或 能吸收
能吸收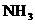 (2分)
(2分)
(3)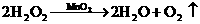
(或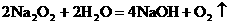 )(2分)
)(2分)
(4)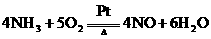 (2分);放热(1分);
(2分);放热(1分);
(5)气体颜色变浅(2分);NO2发生反应: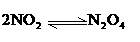 ;ΔH<0,属于放热反应,达到平衡后,若降低温度,平衡向右移动,NO2浓度减少,N2O4浓度增大,N2O4为无色,所以气体颜色变浅(2分)
;ΔH<0,属于放热反应,达到平衡后,若降低温度,平衡向右移动,NO2浓度减少,N2O4浓度增大,N2O4为无色,所以气体颜色变浅(2分)
(6)甲装置产生的氧气量不足。(1分)
11(共15分)
⑴ 取代反应 消去反应 加成反应 (3分)
⑵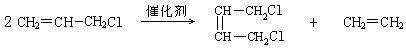 (3分)
⑶ ④ 保护A分子中C=C不被氧化
(3分)
⑶ ④ 保护A分子中C=C不被氧化 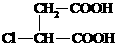 (6分)
(6分)
(4)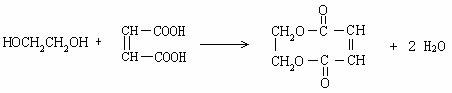 (3分)
(3分)
12(共14分)
(1)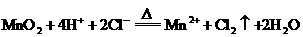 (3分)
(3分)
(2)ABE (3分)
(3)Ⅰ、Ⅱ、Ⅲ (3分)
(4)Cl2 + 8NH3 = 6NH4Cl + N2 (3分) 取适量该白色固体与浓的氢氧化钠溶液共热,产生能使湿润的红色石蕊试纸变蓝的无色气体;另取适量该白色固体溶于水后加硝酸银溶液,产生不溶于稀硝酸的白色沉淀。(3分)
(5)可将尾气通过装有足量稀氢氧化钠溶液的洗气瓶后再排空。(2分)
(其它合理答案也酌情给分)
9. (共16分)
(共16分)
(1)羧基;氧化反应;CH3CHO+2Cu(OH)2 CH3COOH+Cu2O+2H2O
(2)C10H10O2;C8H8O;
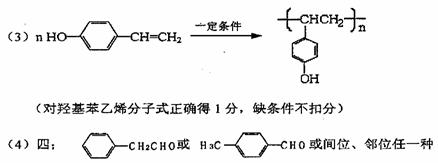
评分:每空2分,共16分。
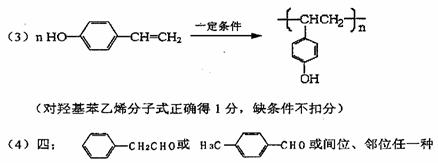
12.(17分)某学生利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。
请回答下列问题:
(1)装置F中发生反应的离子方程式 。
(2)装置A中的烧瓶内固体宜选用 (选填以下选项的代号)
A.碱石灰 B.生石灰 C.二氧化硅 D.五氧化二磷 E.烧碱
(3)虚线框内应添加必要的除杂装置,请从上图的备选装置中选择。并将编号填入下列空格。
B__________、D__________、E__________(填编号)
(4)氯气和氨气在常温下相混就会反应生成氯化铵和氮气,该反应的化学方程式为: ;装置C内出现浓厚的白烟并在容器内壁凝结,请设计一个实验方案鉴定该固体就是氯化铵:
。
(5)从装置C的q处逸出的尾气可能含有污染环境的气体,如何处理?
答: 。
答案(四)1.D 2.A 3.D 4.B 5.D 6.A 7.C 8.C
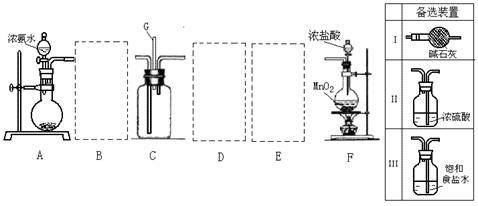
10.课外小组设计了如下图所示的实验装置,进行气体性质实验。图中箭头表示气体流向。A表示一种纯净、干燥的气体,B是另一种气体,反应进行一段时间后,装置己中有红棕色气体生成。实验中所用的药品和干燥剂只能从下列物质中选取:Na2CO3、NaHCO3、MnO2、Na2O2、NaCl、无水CaCl2、NH4HCO3、碱石灰等固体和H2O2、蒸馏水。
根据图中装置和反应现象回答:
(1)充分反应后丙中无固体物质剩余,发生反应的化学方程式为__________________;
(2)丁中的干燥剂应选______________________________,不选另一种干燥剂的理由是____________________________________;
(3)甲中发生反应的化学方程式为____________________________________;
(4)观察到反应开始后断开电键K,铂丝能继续保持红热,戊中发生的主要反应的化学方程式为__________________,此反应是(吸热、放热)__________________反应;
(5)当己中充满红棕色气体后,停止给丙加热,并关闭a、b两个活塞,若将己浸入冰水中,则己中会出现的现象是_______________________________________________,简述产生此现象的原因______________________________________________________。
(6)若装置的气密性良好,甲、丙中均有气体产生,其余操作正常,但己中未观察到红棕色,可能的原因是______________________________________________________。
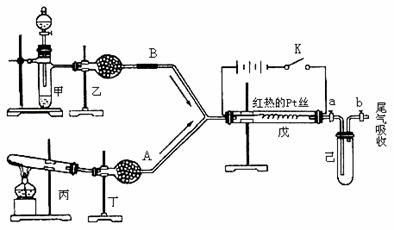
11(15分)2005年的诺贝尔化学奖颁给了3位在烯烃复分解反应研究方面做出突出贡献的化学家。烯烃复分解反应实际上是在金属烯烃络合物的催化下实现C=C双键两边基团换位的反应。如下图表示了两个丙烯分子进行烯烃换位,生成两个新的烯烃分子--丁烯和乙烯。

现以石油裂解得到的丙烯为原料,经过下列反应可以分别合成重要的化工原料I和G。I和G在不同条件下反应可生成多种化工产品,如环酯J。
请按要求填空:
(1)写出下列反应的反应类型:①:_________,⑥:__________,⑧:______________(2)反应②的化学方程式是___________________________________________。
(3)反应④、⑤中有一反应是与HCl加成,该反应是________(填反应编号),设计这一步反应的目的是______________________________________________,物质E的结构简式是_______________________。
(4)反应⑩的化学方程式是___________________________________________。
9.已知一个碳原子连有两个羟基时,易发生下列转化:
 请根据下图回答。
请根据下图回答。
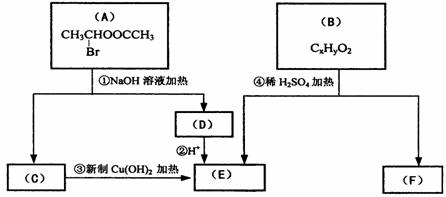
(1)E中含有官能团的名称是 ;③的反应类型是
,C跟新制的氢氧化铜反应的化学方程式为
;
(2)已知B的相对分子质量为162,其燃烧产物中n(CO2): n(H2O)=2 : 1。则B的分子式为 ,F的分子式为 。
(3)在电脑芯片生产领域,高分子光阻剂是光刻蚀0.11μm线宽芯片的关键技术。F是这种高分子光阻剂生产中的主要原料。F具有如下特点:①能跟FeCl3溶液发生显色反应;②能发生加聚反应;③芳环上的一氯代物只有两种。F在一定条件下发生加聚反应的化学方程式为 。
(4)化合物G是F的同分异构体,它属于芳香族化合物,能发生银镜反应。G可能有
种结构,写出其中任一种同分异构体的结构简式
8.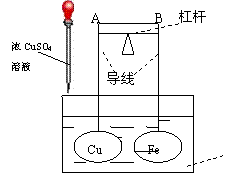 如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向水槽中滴入浓CuSO4 溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑两球的浮力变化)
如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向水槽中滴入浓CuSO4 溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑两球的浮力变化)
A.杠杆为导体或绝缘体时,均为A端高B端低
B.杠杆为导体或绝缘体时,均为A端低B端高
C.当杠杆为导体时,A端低B端高;杠杆为绝缘体
时,A端高B端低
D.当杠杆为导体时,A端高B端低;杠杆为绝缘体
时,A端低B端高
7.以下数值大于或等于阿伏加德罗常数的是
A.含4.8g碳元素的金刚石晶体中的共价键数
B.一定条件下,将0.5mol N2和1.5 mol H2充入一密闭容器内,充分反应后的生成物分子数
C.500mL0.4mol/L的Al2(SO4)3溶液中的离子数
D.64g铜片与含1mol H2SO4的浓硫酸共热,充分反应所转移的电子数
6.某恒温恒容的容器中,建立如下平衡:2NO2(g) N2O4(g),在相同条件下,
N2O4(g),在相同条件下,
若分别向容器中通入一定量的NO2气体或N2O4气体,重新达到平衡后,容器内N2O4的体积分数比原平衡时( )
A.都增大 B.都减小 C.前者增大后者减小 D.前者减小后者增大
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com