
题目列表(包括答案和解析)
21.(14分)(1)某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2。已知该反应中H2O2只发生如下过程:H2O2→O2。
①该反应中的还原剂是 该反应中,发生还原反应的过程是 → 。
②写出该反应的化学方程式,并标出电子转移的方向和数目:
 ③在H2O2中加入乙醚(溶剂,不参与反应)后,再加入数滴K2Cr2O7的硫酸溶液,轻轻振荡后静置,乙醚层呈现现蓝色,这是由于生成的CrO5溶于乙醚的缘故。已知CrO5是含有过氧键(-O-O-)的共价化合物,且Cr的化合价为+6。
③在H2O2中加入乙醚(溶剂,不参与反应)后,再加入数滴K2Cr2O7的硫酸溶液,轻轻振荡后静置,乙醚层呈现现蓝色,这是由于生成的CrO5溶于乙醚的缘故。已知CrO5是含有过氧键(-O-O-)的共价化合物,且Cr的化合价为+6。
a.在1mol CrO5中过氧键(-O-O-)的物质的量为________,
 请在右面的方框中画出其结构式。
请在右面的方框中画出其结构式。
b.写出这一反应的离子方程式________________________
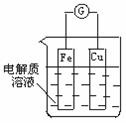
(2) 如图所示,组成一个原电池。①当电解质为稀硫酸时:
电极Fe上的电极反应为 ;
②当电解质为稀硝酸时:电极Cu上的电极反应为____ 。
20.(共12分)某研究性学习小组对“氢硫酸长期存放会变浑浊”十分感兴趣,为了探究其原因,他们分别做了如下实验:
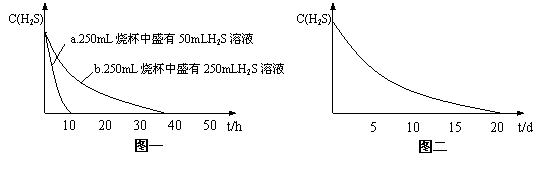 实验一:将H2S气体溶于蒸馏水制成氢硫酸饱和溶液,在空气中敞口放置1-2天未见浑浊现象。用相同浓度的碘水去滴定氢硫酸溶液测其浓度。图一所示为两只烧杯中氢硫酸浓度随时间变化而减小的情况。
实验一:将H2S气体溶于蒸馏水制成氢硫酸饱和溶液,在空气中敞口放置1-2天未见浑浊现象。用相同浓度的碘水去滴定氢硫酸溶液测其浓度。图一所示为两只烧杯中氢硫酸浓度随时间变化而减小的情况。
 实验二:密闭存放的氢硫酸,每天定时取1mL氢硫酸,
用相同浓度的碘水滴定,图二所示为氢硫酸浓度随放置天数变化的情况。
实验二:密闭存放的氢硫酸,每天定时取1mL氢硫酸,
用相同浓度的碘水滴定,图二所示为氢硫酸浓度随放置天数变化的情况。
实验三:在饱和氢硫酸溶液中以极慢的速度通入空气(1-2个气泡/min),数小时未见变浑浊的现象。
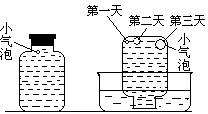 实验四:盛满试剂瓶,密闭存放的饱和氢硫酸溶液隔2-3天观察,直到略显浑浊;当把满瓶的氢硫酸倒扣在培养皿中观察2-3天,在溶液略显浑浊的同时,瓶底仅聚集有少量的气泡,随着时间的增加,这种气泡也略有增多(大),浑浊现更明显些。
实验四:盛满试剂瓶,密闭存放的饱和氢硫酸溶液隔2-3天观察,直到略显浑浊;当把满瓶的氢硫酸倒扣在培养皿中观察2-3天,在溶液略显浑浊的同时,瓶底仅聚集有少量的气泡,随着时间的增加,这种气泡也略有增多(大),浑浊现更明显些。
请回答下列问题:
(1)实验一(见图一)中,氢硫酸的浓度随时间变化而减小的主要因素是_______________。
(2)实验一和实验二中,碘水与氢硫酸反应的化学方程式为_______________。两个实验中准确判断碘水与氢硫酸恰好完全反应是实验成功的关键。请设计实验方案,使实验者准确掌握所加碘水恰好与氢硫酸完全反应。___________________________________。
(3) “氢硫酸长期存放会变浑浊”中,出现浑浊现象是由于生成了_______的缘故。
(4)该研究性学习小组设计实验三说明他们认为“氢硫酸长期存放会变浑浊”的假设原因之一是(用文字说明)______________________。此实验中通入空气的速度很慢的主要原因是什么?________________________________。
(5)实验四的实验现象说明“氢硫酸长期存放会变浑浊”的主要原因可能是_________。为进一步证实上述原因的准确性,你认为还应做哪些实验(只需用文字说明实验设想,不需要回答实际步骤和设计实验方案)?_____________________________________。
19.(10分)(1)下列是某学习小组的同学关于某无色溶液中所含离子鉴别的实验设计方案。请指出存在问题的实验方案,并说明理由(有几组写几组,不一定填满,多写倒扣分)。
A.加入KSCN溶液后溶液不显红色,再加几滴氯水溶液颜色变为红色。说明原溶液中含Fe2+
B.加入BaCl2溶液,生成白色沉淀,加稀硝酸沉淀不消失,可确定有SO42-存在
C.通入Cl2后,溶液由无色变为黄色,加入淀粉溶液后溶液变蓝,可确定有I-存在
D.加入盐酸后,生成的气体能使澄清石灰水变浑浊,则原溶液中一定有CO32-
E.加入浓NaOH溶液并加热产生使湿润红色石蕊试纸变蓝的气体,说明溶液中含NH4+
① 。
② 。
③ 。
(2)实验室配制95mL0.100mol/LCuSO4溶液,回答下列问题:
 ①用电子天平(如右图)称取硫酸铜晶体时读数应是
g 。
①用电子天平(如右图)称取硫酸铜晶体时读数应是
g 。
(该天平最小读数是1mg,不需估读)
②使用容量瓶配制溶液时,下列情况会使所配溶液浓度偏低的是_________________。
A.称重前发现晶体有风化(失去部分或全部结晶水)的现象
B.移溶液前容量瓶内有少量蒸馏水
|
D.定容时,俯视容量瓶的刻度线
E.容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
18.有甲、乙两醋酸稀溶液,测得甲的pH=a,乙的pH=a+1。下列推断中正确的是:
A.物质的量浓度c(甲)=10c(乙)
B.甲中由水电离产生的H+的物质的量浓度是乙的0.1倍
C.中和等物质的量浓度等体积的NaOH溶液需甲、乙两酸的体积V(乙)> 10V(甲)
D.甲中的c(OH-)为乙中c(OH-)的10倍
第Ⅰ卷(选择题 共74分) 班级: 姓名:
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
第Ⅱ卷(非选择题(共76分)
17.将2
mol X、3 mol Z两种气体混合于某体积不变的密闭容器内发生如下反应:2X(g )+Y(g) 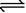 3 Z(g)平衡时,生成n molZ。恒温恒压时,按下列配比投入各物质,达到平衡时,Z的物质的量大于n mol的是:
3 Z(g)平衡时,生成n molZ。恒温恒压时,按下列配比投入各物质,达到平衡时,Z的物质的量大于n mol的是:
A.3.2 mol X、0.6 mol Y、1.2 mol Z
B.3.6 mol X、1 mol Y、0.6 mol Z
C.2.8 mol X、0.4 mol Y、1 mol Z
D.2.2 mol X、0.2 mol Y、2.4 mol Z
16.
 在一定条件下,固定容积的密闭容器中反应:2NO2(g)? O2(g)+ 2NO(g);ΔH>0, 达到平衡。当改变其中一个条件X,Y随X的变化符合图中曲线的是
在一定条件下,固定容积的密闭容器中反应:2NO2(g)? O2(g)+ 2NO(g);ΔH>0, 达到平衡。当改变其中一个条件X,Y随X的变化符合图中曲线的是
A、当X表示反应时间时,Y表示混合气体的密度
B、当X表示压强时,Y表示NO2的转化率
C、当X表示温度时,Y表示NO2的物质的量
D、当X表示NO2的物质的量时,Y表示O2的物质的量
15.Va L pH=2的盐酸与Vb L pH=12的氨水混合,若所得溶液显酸性,下列有关判断正确的是
A.Va 一定等于 Vb
B.Va 一定大于 Vb
C.混合溶液中离子浓度一定满足: c(Cl-) > c(NH4+)> c(H+)> c(OH-)
D.混合溶液中离子浓度一定满足: c(NH4+) + c(H+) = c(Cl-)+ c(OH-)
14.将物质的量相等的Al2(SO4)3和(NH4)2SO4溶于水,形成V L混合溶液,向该混合溶液中逐滴加入某NaOH溶液(其物质的量浓度为混合溶液中两溶质的物质的量浓度之和),直至过量。下列各图示中,能正确表示加入NaOH溶液的体积(x)与生成沉淀的物质的量(y)的关系的是
13.铊(Tl)是某超导材料的组成元素之一,与铝同族,位于第6周期。Tl3+与Ag在酸性介质中发生反应:Tl3++ 2Ag ==Tl+ + 2Ag+。下列推断正确的是
A.Tl+ 的最外层有1个电子 B.Tl 3+的氧化性比Al3+的弱
C.Tl能形成+3价和+1的化合物 D.Tl+ 的还原性比Ag强
12.一种新型燃料电池,以镍板为电极插入KOH溶液中,分别向两极通乙烷和氧气,电极反应式为:C2H6+18OH--14e-=2CO32-+12H2O;7H2O+7/2O2+14e-=14OH-。有关此电池的推断错误的是
A.通氧气的电极为负极
B.参加反应的O2与C2H6的物质的量之比为7∶2
C.电池工作一段时间后,KOH的物质的量浓度将下降
D.在电解质溶液中CO32-向正极移动
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com