
题目列表(包括答案和解析)
|
(3)②4NH3+5O2 = 4NO+6H2O (4)⑤C+4HNO3(浓)=CO2↑+4NO2↑+2H2O
|
(5)2NH4++2e- = 2NH3↑+H2↑
24. (10分) (1) H2O2 CO2 Fe3O4 (各1分)
(2) FeC2O4 CO↑+CO2↑+FeO (3分)
CO↑+CO2↑+FeO (3分)
(3) 4 HCl + MnO2

 MnCl2 + Cl2 ↑ + 2H2O (2分)
MnCl2 + Cl2 ↑ + 2H2O (2分)
(4) 2Fe3+ + Fe = 3 Fe2+ (2分)
22. (10分) (1) 2 (2分) 4 (2分) (2)相等(2分) 0.6(2分) (3)8:5(2分)
21.(14分)⑴ ①H2O2 H2CrO4 Cr(OH)3
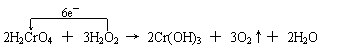
②
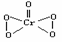
③a.2mol b .Cr2O72-+4H2O2+2H+=2 CrO5+5H2O
(2) ① Fe-2e-=Fe2+ ; ②4H++NO +3e-=NO↑+2H2O
+3e-=NO↑+2H2O
20.(12分)(1)硫化氢的挥发(2分)
(2)H2S+I2==2HI+S↓(1分)向氢硫酸中加入淀粉液,滴加碘水到溶液刚好呈蓝色。(2分)
(3)S或硫(1分) (4)氢硫酸被空气中氧气氧化(1分)防止因通入空气过快而使硫化氢大量挥发(2分) (5)硫化氢自身分解(1分)确证生成的气体是氢气(2分)
19.(10分)(1) ①B 白色沉淀也可能是氯化银(3分) ②D 具有这一实验现象的也可能是亚硫酸根等离子 (3分) (2)2.500 CE (4分)
26. (8分)铁粉和铜粉的均匀混合物,平均分成三等份,分别加入同浓度的稀硝酸,充分反应,在标准状况下生成NO的体积和剩余金属的质量如下表(设硝酸的还原产物只有NO):
|
编号 |
① |
② |
③ |
|
稀硝酸体积/mL |
100 |
200 |
300 |
|
剩余金属/g |
30.4 |
22 |
12.8 |
|
NO体积/mL |
2240 |
4480 |
6720 |
由上述数据推测:
(1)求硝酸的物质的量浓度。
(2)③中比②中多溶解金属的成分是什么?其相应的质量为多少克?
(3)向反应后的①中加入足量的该稀硝酸时,又生成气体的体积在标准状况下为多少L?
高三化学综合练习(五)答案:
25. (6分)将12.6克无水亚硫酸钠固体加入100 mL 8 mol·L-1的硫酸中以制取SO2气体,反应完全后,若溶液中含+4价硫元素的物质的总浓度为0.2 mol·L-1,假定溶液体积不变,忽略容器及导管中的气体体积,求:
(1)反应完全后溶液中硫元素的质量.
(2)收集到SO2气体的体积(标准状况下)。
24.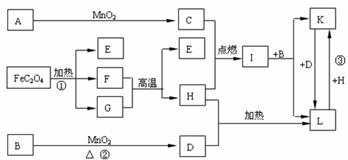 (10分)下列A-L 11种物质是中学化学常见物质,其中C、D、E、F为气体,C、D、H为单质。1 mol FeC2O4在反应①中转移1 mol电子。它们有如下图所示的转化关系(部分反应中的生成物已略去),试回答:
(10分)下列A-L 11种物质是中学化学常见物质,其中C、D、E、F为气体,C、D、H为单质。1 mol FeC2O4在反应①中转移1 mol电子。它们有如下图所示的转化关系(部分反应中的生成物已略去),试回答:
(1) 写出有关物质的化学式:A__________、E__________、I____________。
(2) 写出反应①中化学方程式_____________________________________________。
(3)写出反应②中化学方程式_____________________________________________。
(4) 写出反应③中的离子方程式 。
23.(8分)已知A为常见金属,X、Y为常见非金属,X、E、F、G常温下为气体,C为液体,B是一种盐,受热极易分解,在工农业生产中用途较广(如被用作某些电池的电解质)。现 用A与石墨作电极,B的浓溶液作电解质,构成原电池。有关物质之间的转化关系如下图:
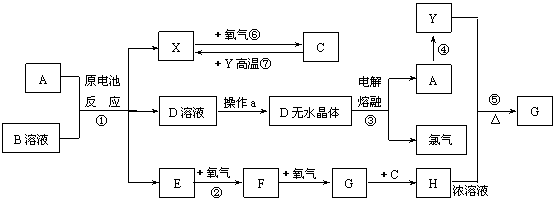 (注意:其中有些反应的条件及部分生成物被略去)
(注意:其中有些反应的条件及部分生成物被略去)
请填写下列空白:
(1)反应④为A在某种气体中燃烧,生成单质Y和A的氧化物,其反应方程式为
。
(2)从D溶液制备D的无水晶体的“操作a”为 。
(3)反应②的化学方程式为 。
(4)反应⑤的化学方程式为 。
(5)原电池反应①中正极的电极反应式为 。
22. (8分)有甲、乙两个容积相等的恒容密闭容器,向甲中通入6mol A和2mol B,向乙中通入1.5molA、0.5molB和3molC,将两容器的温度恒定在770K,使反应
(8分)有甲、乙两个容积相等的恒容密闭容器,向甲中通入6mol A和2mol B,向乙中通入1.5molA、0.5molB和3molC,将两容器的温度恒定在770K,使反应
3A(g)+B(g) xC(g)达到平衡,此时测得甲、乙两容器中C的体积分数都为0.2,试回答下列有关问题:
(1)若平衡时,甲、乙两容器中A的物质的量相等,则x= ,若平衡时,甲、乙两容器中A的物质的量不.相等,则x= 。
(2)平衡时,甲、乙两容器中A、B的物质的量之比是否相等 (填“相等”或“不相等”),平衡时甲中A的体积分数为 。
(3)若平衡时两容器中的压强不相等,则两容器中压强之比为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com