
题目列表(包括答案和解析)
4.某溶液中加入铝粉有氢气产生,该溶液中一定可以大量共存的离子组是( )
A.Na+、NO3-、Cl-、SO42- B.Na+、K+、Ba2+、HCO3-
C.Fe3+、H+、SO42-、Cl- D.Na+、K+、Cl-、SO42-
3.下列离子在溶液中因发生氧化还原反应而不能大量共存的是 ( )
A.H3O+、NO3-、Fe2+、Na+ B.Ag+、NO3-、Cl-、K+
C.K+、Ba2+、OH-、SO42- D.Cu2+、NH4+、Br-、OH-
2.下列澄清透明的溶液中,可能大量共存的离子组是
A.[Ag(NH3)2]+、K+、OH-、NO3- B.Fe3+、NH4+、Cl-、I-
C.H+、Al3+、SO42-、F- D.NH4+、Na+、Cu2+、Cl-
1.某无色透明的溶液,在pH=0和pH=14的条件下都能大量共存的是( )
A.Fe2+、K+、SO42-、NO3- B.Mg2+ 、NH4+、SO42-、Cl-
C.Na+、K+、SO42-、NO3- D.Ba2+ 、Na+ 、MnO4- 、SO42-
26.(9分)将等物质的量的两种中学化学常见的氧化物溶于100mL硫酸,而后逐滴加入1.00mol/L的NaOH溶液。当加入的NaOH的体积V1=50mL时,开始有沉淀析出,且沉淀量随NaOH的加入量增加而逐渐增加。当NaOH的体积V2=650mL时,沉淀量达到最大值,继续滴加NaOH时,沉淀量逐渐减小。当V2≥750mL时,沉淀量不再改变。
⑴最初加入的50mLNaOH溶液的作用是__________________________________。
⑵计算所用的硫酸的物质的量浓度。
⑶试判断两种氧化物各是什么,并计算其物质的量。
25.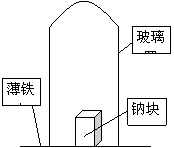 (8分)据材料称:钠可在氮气中燃烧生成氮化钠,氮化钠与水反应的化学方程式是:Na3N+4H2O==3NaOH+NH3·H2O。某学校化学研究学习小组,为了研究钠在空气中燃烧产物的成分,做了以下实验:取11.5g钠单质放在一块薄铁皮上,上扣一玻璃罩(玻璃罩内为干燥且无酸性气体的空气),用酒精灯加热薄铁皮,钠完全燃烧,将燃烧产物投入水中,得到一种纯净气体0.224L(标准状况)和1000mL溶液,从中取出25.00mL溶液,与13.50mL 1.00mol·L-1HCl溶液刚好完全反应。求钠在空气中燃烧产物的成分及物质的量。
(8分)据材料称:钠可在氮气中燃烧生成氮化钠,氮化钠与水反应的化学方程式是:Na3N+4H2O==3NaOH+NH3·H2O。某学校化学研究学习小组,为了研究钠在空气中燃烧产物的成分,做了以下实验:取11.5g钠单质放在一块薄铁皮上,上扣一玻璃罩(玻璃罩内为干燥且无酸性气体的空气),用酒精灯加热薄铁皮,钠完全燃烧,将燃烧产物投入水中,得到一种纯净气体0.224L(标准状况)和1000mL溶液,从中取出25.00mL溶液,与13.50mL 1.00mol·L-1HCl溶液刚好完全反应。求钠在空气中燃烧产物的成分及物质的量。
24.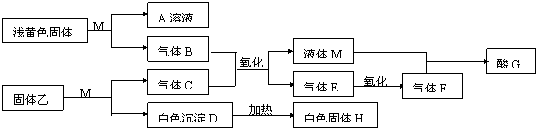 (14分)M为一种常见的液体试剂。下列物质在一定条件下可发生如下图所示的转化关系。
(14分)M为一种常见的液体试剂。下列物质在一定条件下可发生如下图所示的转化关系。
试填写题中空白:
(1) 若固体乙是硫化铝,试回答:
①C、E、F化学式C 、E 、F
②E→F的化学方程式
③D溶解于A溶液的离子方程式
(2)若白色沉淀D不能溶解于A溶液,气体C能使湿润的红色石蕊试纸变蓝,回答:
④固体乙可能
⑤B+C→M+E的化学方程式
23.(8分)在一定温度下,向一个容积不变的容器中,加入3molSO2和2molO2 及固体催化剂,使之反应。2SO2(g) + O2 (g) 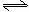 2SO3 (g) ;△H=-196.6kJ/mol。平衡时容器内气体压强为起始时的90%。此时
2SO3 (g) ;△H=-196.6kJ/mol。平衡时容器内气体压强为起始时的90%。此时
(1)加入3molSO2和2molO2 发生反应,达到平衡时,放出的热量为 。
(2)保持温度不变,在相同的容器中,将起始物质的量改为amolSO2、bmolO2、cmolSO3(g)(C>0),欲使平衡时SO3的体积分数为2/9 ,O2的体积分数为1/3,
①达到平衡时,Ⅰ与Ⅱ放出的热量 (填序号)。
A. 相等 B. 前者小于后者 C. 前者大于后者 D无法确定
②a、b、c必须满足的关系是 、 。
(一个用a、c表示,另一个用b、c表示)
③欲使起始时反应表现为向正反应方向进行,a的取值范围是: 。
22.(9分)⑴常温下将0.2mol/LHCl溶液与0.2mol/LMOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
①混合溶液中由水电离出的c(H+) 0.2mol/LHCl溶液中由水电离出的c(H+);
(填“>”、“<”、或“=”)
②求出混合溶液中下列算式的精确计算结果(填具体数字):
c(Cl-)-c(M+)= mol/L;c(H+)-c(MOH)= mol/L。
⑵常温下若将0.2mol/LMOH溶液与0.1mol/LHCl溶液等体积混合,测得混合溶液的pH<7,则说明在相同条件下MOH的电离程度 MCl的水解程度。(填“>”、“<”、或“=”)
⑶常温下若将pH=3的HR溶液与pH=11的NaOH溶液等体积混合,测得混合溶液的pH≠7,则混合溶液的pH_________。(填“>7”、“<7”、或“无法确定”)
21.(11分)已知下列反应(反应所需的其他条件和各物质的化学计量数均已略去):
①A+B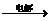 M+D+E;②M+E→A+F+B。请针对以下两种不同情况回答:
M+D+E;②M+E→A+F+B。请针对以下两种不同情况回答:
⑴若A是一种钠盐,反应①是化学工业上制取单质E和化合物M的重要方法。则A的电子式为_________________;反应②的离子方程式为_____________________________;
在酸性条件下,若将化合物F加到含Fe2+的溶液中,溶液从浅绿色变成黄色,该反应的离子方程式为____________________________________________________。
⑵若A是一种含氧酸盐,可用于实验室中检验水的存在。1个A的酸根离子中共含有50个电子,其中含有一种元素X,X的原子最外层电子数是电子层的2倍,则X在元素周期表中的位置是第________周期_______族。X单质的熔点是112.8℃,则X单质的晶体类型属于__________晶体。X与碳单质在一定条件下可以生成CX2的化合物,其分子结构类似于CO2,则CX2属于(填“极性”或“非极性”)_____________分子。反应②的化学方程式为_______________________________________________________。
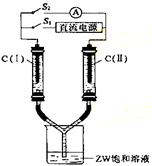 (3)如右图所示装置,两玻璃管中盛满滴有酚酞溶液的
(3)如右图所示装置,两玻璃管中盛满滴有酚酞溶液的
ZW饱和溶液,C(Ⅰ)、C(Ⅱ)为多孔石墨电极。接
通S1后,C(Ⅰ)附近溶液变红,两玻璃管中有气体生成。
一段时间后(两玻璃管中液面未脱离电极),断开S1,
接通S2,电流表的指针发生偏转。此时:C(Ⅰ)的电极
名称是: ,
(填写“正极”、“负极”、“阴极”、“阳极”);
C(Ⅱ)的电极反应式是: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com