
题目列表(包括答案和解析)
2.(★★★★)Cu+在酸性溶液中不稳定,可发生自身氧化--还原反应生成Cu2+和Cu。现有浓H2SO4、浓HNO3、稀H2SO4、稀HNO3、FeCl3(aq)、pH试纸,而没有其他试剂。请用最简便的实验方法来证明CuO经H2还原所得到的红色产物中是否含有碱性氧化物Cu2O。
1.(★★★)用实验证明某酸HA是弱电解质。两同学的方案分别是:
甲:①称取一定量的HA配制0.1 mol·L-1的溶液100 mL。
②用pH试纸测出该溶液的pH,即可证明HA是弱电解质。
乙:①用已知物质的量浓度的HA溶液、盐酸,分别配制pH=1的两种酸溶液各100 mL;
②分别取这两种溶液各10 mL,加水稀释为100 mL;
③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质。
(1)在两个方案的第①步中,都要用到的定量仪器是________。
(2)甲方案中,说明HA是弱电解质的理由是测得溶液的pH 1(选填“>”“<”“=”)
乙方案中,说明HA是弱电解质的现象是________(多选扣分)。
a.装HCl(aq)的试管中放出H2的速率快;
b.装HA(aq)的试管中放出H2的速率快;
c.两个试管中产生气体速率一样快。
(3)请你评价:乙方案中难以实现之处和不妥之处 、 。
(4)请你再提出一个合理而比较容易进行的方案(药品可任取),作简明扼要的表述________。
2.几何证明题:利用数学工具推证某些结论正确与否。要注意图形的转换,以及化学习题与数学方法的联系。
●歼灭难点训练
1.实验证明题:根据实验现象判断某些物质存在与否、验证某些结论正确与否。要注意化学试剂的选择。
25.(14分) 将3.20g Cu溶于B mol/L过量的硝酸溶液30.0 mL中,假设硝酸的还原产物只有NO2和NO,反应结束后,将所剩溶液加水稀释至1000 mL,测得c(NO3-)=0.200 mol/L。
(1)试求稀释后溶液的pH。
(2)生成的气体中NO2和NO的物质的量(可以含有B的代数式表示)。
(3)用NaOH溶液吸收氮的氧化物是防止NOx污染的一种方法。原理为:
2NO2+2NaOH=NaNO3+NaNO2+H2O,NO+NO2+2NaOH=2NaNO2+H2O
若生成的混合气体能被NaOH溶液完全吸收,试讨论B的取值范围。
24.(12分)根据反应框图填空,已知反应①-⑤均为工业生产及应用中常见反应,其中B、G、I、J、L均为常见单质,B、D、J、L为气体。A是工业生产F的重要矿石原料的主要成份,其相对分子质量为120。
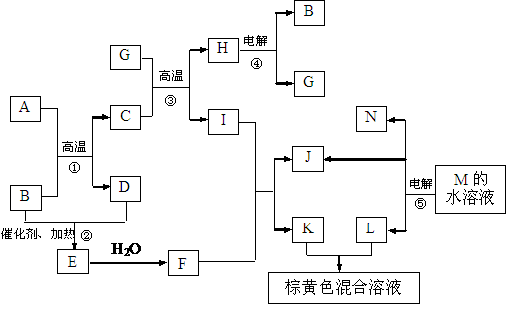
(1)写出A、B的化学式
A__________________ B____________________
(2)写出下列化学反应方程式:
反应②的化学方程式_________________________________________________
反应③的化学方程式_________________________________________________
反应⑤的离子方程式_________________________________________________
(3)写出反应①所使用设备的名称_________________________________
23.(10分)M为一种常见的液体试剂。下列物质在一定条件下可发生如下图所示的转化关系。
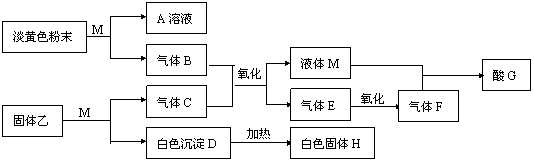 回答下列问题:
回答下列问题:
⑴ 写出淡黄色粉末和M反应的化学方程式 ;
⑵若固体乙是硫化铝,则:
①C化学式是 ,G的化学式是 ;
②H溶解于A溶液的离子方程式是 ;
⑶若白色沉淀D不能溶解于A溶液,气体C能使湿润的试纸变蓝,则固体乙的化学式可能是 。
22. (8分)有资料报道:铁酸钠(Na2FeO4)是一种强氧化剂,可作为一种新型净水剂,在反应中被还原为Fe3+离子,使用该物质可代替Cl2和Al2(SO4)3。
(1)用废铁屑制Fe2O3 。向有铁锈的废铁屑中加入稀硫酸,至铁屑全部溶解。再通过系列化学过程得到Fe2O3 。写出向有铁锈的废铁屑中加入稀硫酸过程中的离子反应方程式______________________________________________________________。
(2)制备铁酸钠。氧化铁在碱性溶液中与硝酸钠反应制得铁酸钠。
Fe2O3 +NaNO3 +NaOH → Na2FeO4+NaNO2 +H2O (未配平)
当反应物中含有1.4 mol Na+ ,上述反应恰好完全进行时,电子转移总数为_______NA。
(3) 制备铁酸钠后的废液中含NaNO2溶液,直接排放会造成污染,下列试剂中①NaCl ②NH4Cl ③KMnO4 ④浓硫酸,能使NaNO2转化为N2(不引起二次污染的)的是________(选填试剂编号),离子反应方程式________________________________。
21.(8分)位于短周期的四种主族元素A、B、C、D原子序数依次增大,已知A、C位于同一主族,A在周期表中原子半径最小。B、D的最外层电子数相等,且B、D的原子序数之和为A、C原子序数之和的两倍。根据你的推断回答下列问题:
(1)写出由上述元素形成的具有漂白作用的四种物质的化学式
、 、 、 。
(2)C与D形成D的最低价化合物的电子式: 。
(3)仅由B、C、D三种元素形成的一种盐,溶于水后呈碱性,请用一个离子方程式表示其呈碱性的原因: 。
20.(14分)喷泉实验是中学化学的一个重要性质实验,同时喷泉也是一种自然现象。其产生原因是存在压强差。试根据下图,回答下列问题:
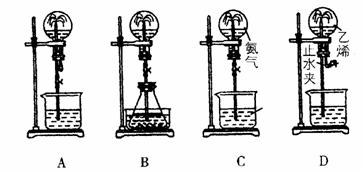
(1)在图A的烧瓶中充满干燥气体,胶头滴管及烧杯中分别盛有相同液体。下列组合中不可能形成喷泉的是 。
A.HCl和H2O B.NH3和H2O
C.Cl2和H2O D.CO2和NaOH溶液
(2)在图B的锥形瓶中,分别加入足量的下列物质,反应后可能产生喷泉的是 ,这种方法产生喷泉的原理是 。
A.Cu与稀盐酸 B.NaHCO3与NaOH溶液
C.CaCO3与稀硫酸 D.NH4HCO3与稀盐酸
(3)在图B的锥形瓶外放一水槽,锥形瓶中加入酒精,水槽中加入冷水后,再加入足量的下列物质,结果也产生了喷泉。水槽中加入的物质可以是 。
A.浓硫酸 B.食盐 C.硝酸铵 D.硫酸铜
(4)城市中常见的人造喷泉及火山爆发的原理与上述 (填“图A”或“图B”)装置的原理相似。
(5)如果只提供如图C的装置,引发喷泉的方法是 。
(6)图D是用的排水取气法收集的一瓶乙烯,请你根据喷泉原理和乙烯的化学性质,在图D的基础上设计一个方案,使它产生喷泉,力求使水充满整个烧瓶。简述其操作: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com