
题目列表(包括答案和解析)
2、在外加电场下氢氧化铁胶体微粒向阴极移动的原因是( )
A、Fe3+带正电荷
B、Fe(OH)3带负电吸引阳离子
C、在氢氧化铁胶体微粒吸附阳离子而带正电荷
D、氢氧化铁胶体吸附阴离子带负电荷
1、共价键、离子键和范德瓦尔斯力是构成物质粒子间的不同作用方式,下列物质中只含有上述一种作用的是( )
A、干冰 B、氯化钠 C、氢氧化钠 D、碘
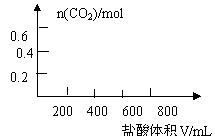
26、将35.8gNa2CO3和NaHCO3的固体混合物溶于足量水中,向其中逐滴加入
1mol·L-1的盐酸至不再产生气体为止,测得共产生CO28.96L(标准状况)
(气体溶解忽略不计)。回答:
⑴原混合物中Na2CO3为 _______________g
⑵若以滴加盐酸的体积为V(mL),产生气体的物质的量为n(mol),建立n=f(V)的函数关系,将V在不同取值时,n=f(V)的关系式填入下表并作图
|
V值 |
 n=f(V) n=f(V) |
|
|
|
|
|
|
|
|
|
25、有一铁粉、氧化铜、氧化铁组成的混合物,将其投入到110mL 4mol·L-1的盐酸中充分反应后,放出气体896mL(标准状况下测定),过滤所得固体干燥后称重,其质量为1.28g,滤液经分析检验确认其中无Cu2+,将滤液稀释到200mL,从中取出50mL,逐渐加入1mol·L-1的NaOH溶液,当加入了20mL 后,再向滤液中加NaOH溶液则出现沉淀。求混合物中铁粉的质量分数
24.下图是中学化学中常见的物质间化学反应关系的图示,其中未注明用量的物质间的反应,均按恰好充分反应处理,其他有关信息已在图中注明,试回答:
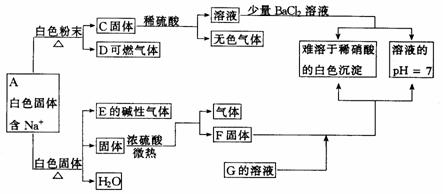
(1) 写出化学式A___________C___________D___________
E____________F____________G____________
(2)F与G在溶液中反应的离子方程式是 .
(3)白色固体B的化学式能否确定____________,理由是________________________.
23、(6分)A、B、C、D、E五种元素均为元素周期表中前三周期元素,且原子序数依次增大,A、B可形成两种液态化合物,其最简式分别为AB和A2B;A与E可形成极易溶于水的气体AE;C、D、E三种原子最外层共有12个电子,且D的最高价氧化物可溶于C的最高价氧化物对应水化物的溶液中。请写出:
⑴E原子结构示意图______________
⑵最简式为AB的化合物的电子式____________________
⑶D的最高价氧化物属于_____ 晶体类型,
C的最高价氧化物对应水化物中存在的化学键有________________________,
二者反应的化学方程式为____________________ .
22、在2L的密闭容器中,加入2mol A和1mol B,发生下述反应:
2A(g)+B(g)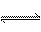 2C(g)+D(s)达到平衡时,C的浓度为0.4mol·L-1
2C(g)+D(s)达到平衡时,C的浓度为0.4mol·L-1
⑴温度不变,若缩小容器的体积,则平衡_______移动(填正向、逆向或不)
⑵维持容器的温度和体积不变,按下列四种配比作为起始物质,达到平衡后,C的浓度
仍是0.4mol·L-1的是________。
A、4molA+2molB B、2molC+1molD
C、2molA+1molB+2molC+1molD D、1molA+0.5molB+1molC+0.2molD
⑶若维持容器的体积和温度不变,按不同配比加入起始物质,达到平衡时,C的浓度仍是0.4mol·L-1。
①反应从逆反应方向开始,则D的起始物质的量应满足的条件是________
②若加入0.2molA和0.1molB,则C和D起始物质的量分别
应满足________________, _____________
21、市面上出售的干电池大多对环境构成污 染,如废旧电池含有的高浓度氯化铵溶液使土壤酸化,以及重金属污染等。据报道美国人每年抛弃27亿节电池。这些废弃电池的日积月累,会严重影响地球生态。某中学研究性学习小组的学生发明一种新型环保电池,其结构简单,取材容易,一般家庭都能制造。同时还具有废物利用、电极材料及电解质用完后可更换、电解液对环境污染小等特点。他们所用的原料有:铁、铝(可取用废弃的易拉罐)、家庭常用的漂白水(含次氯酸根离子)、食盐、氢氧化钠(一般化学药店有售)。
根据上述所用材料指出该电池的负极材料_______,正极材料_______
写出电极反应式:负极___________________;正极______________________
20.下表是元素周期表中短周期元素的一部分,表中所列字母分别代表一种元素。
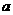
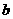
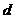
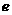
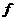
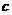
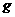
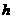
(1)上述元素的单质中熔点最高的可能是 _____(填字母)。
(2)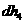 比
比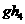 稳定,其原因是______________________________________的缘故。
稳定,其原因是______________________________________的缘故。
(3)在一定条件下,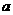 与
与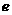 可形成一种极易溶于水的气态化合物,其电子式为
;该物质溶于水后的溶液呈 性(填“酸”、“碱”或“中”),这是由于___________________________________________________(结合该物质分子结构的特点解释)
可形成一种极易溶于水的气态化合物,其电子式为
;该物质溶于水后的溶液呈 性(填“酸”、“碱”或“中”),这是由于___________________________________________________(结合该物质分子结构的特点解释)
(4)现有另一种元素,其原子获得一个电子所释放出能量是上表中所列元素中最大的,则X是周期表中_________族元素。
(5)“神舟”六号载人飞船内需要有一种化合物来吸收航天员呼出的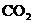 ,你认为该物质应该是由上表中的_______(填字母)元素组成的,用电子式表示该物质的形成_____________________________________________。飞船中需要制造一种适合航天员生存的人工态环境,还应该在氧气中充入一种稀释气体,该气体分子式为________。另在运送飞船的火箭推进器中盛有分别由ae和af元素组成的两种液态化合物,它们的分子皆为18电子微粒,当它们混合反应时即产生e的单质和a2f。请写出该反应的化学方程式为____________________________。这个反应应用于火箭推进器,除释放大量的热和快速产生大量气体外,还有一个很大的优点是______________________________________________。
,你认为该物质应该是由上表中的_______(填字母)元素组成的,用电子式表示该物质的形成_____________________________________________。飞船中需要制造一种适合航天员生存的人工态环境,还应该在氧气中充入一种稀释气体,该气体分子式为________。另在运送飞船的火箭推进器中盛有分别由ae和af元素组成的两种液态化合物,它们的分子皆为18电子微粒,当它们混合反应时即产生e的单质和a2f。请写出该反应的化学方程式为____________________________。这个反应应用于火箭推进器,除释放大量的热和快速产生大量气体外,还有一个很大的优点是______________________________________________。
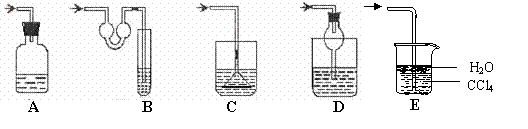
19.以下各种尾气吸收装置中,适合于吸收HCl气体,而且能防止倒吸的有( )

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com