
题目列表(包括答案和解析)
3、一定温度下,将2molA、2molB、2molC的气体混合物充入一体积不变的密闭容器中,充分反应后恢复到起始温度,测得容器内的压强比起始时增大20%,则容器中可能发生的反应是
A.2A+B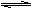 2C B.A+B
2C B.A+B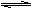 2C C.2A+B
2C C.2A+B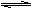 C D.A+B
C D.A+B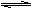 3C
3C
2、某温度下,在一容积可变的容器里,反应2A(g) 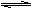 B(g) + 2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol、4mol。在保持温度和压强不变的条件下,下列说法正确的是
B(g) + 2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol、4mol。在保持温度和压强不变的条件下,下列说法正确的是
A.充入1mol稀有气体氦(He),平衡将向正反应方向移动
B.充入A、B、C各1mol,平衡将向正反应方向移动
C.将A、B、C各物质的量都减半,C的百分含量不变
D.加入一定量的A气体达平衡后,C的百分含量一定增加
1、在一密闭容器中,反应 aA(g)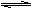 bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,A的浓度变为原来的60%,则( )
bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,A的浓度变为原来的60%,则( )
A.平衡向正反应方向移动了 B.平衡向逆反应方向移动了
C.物质B的质量分数增加了 D.a<b
腐蚀快慢的判断方法:
电解原理引起的腐蚀>原电池原理引起的腐蚀>有防腐措施引起的腐蚀
紧扣:负极:氧化反应 正极:还原反应
[例题2]已知下列原电池的总反应式,请写出电极反应式
(1)Cu+2FeCl3==CuCl2+2FeCl2 (2)CH4+O2+KOH==K2CO3+3H2O
负极:Cu-2e-== Cu2+ 负极:CH4-8 e-+10OH-== CO32-+7H2O
正极:2Fe3++2 e-==2Fe2+ 正极:2 O2+7H2O+8 e-==8OH-
[小结]书写原电池电极反应式的基本思路:
(1)负极:还原剂-n e-==氧化产物 正极:氧化剂+ n e-==还原产物
(注意分析参与电极反应产生的粒子能否与电解质反应,如能反应,写反应后的产物。如例2的负极反应)。
[例题3]将例题2中的反应(1)设计成原电池。画出装置图并注明电极材料及电解质溶液的名称。
点拨:(1)确定两极的电极材料(图中应注明)
(2)确定电解质溶液(图中不能漏画)
(3)画图要规范
新型电池分析
[例题4]阿波罗宇宙飞船上使用的是氢氧燃料电池,其电池反应为2H2+O2==2H2O,电解液为KOH,反应保持在较高温度,使H2O蒸发,下列叙述正确的是( D )
A、此电池能发出蓝色火焰
B、H2为正极,O2为负极
C、工作时,电解液的pH不断减小
D、电极反应为:负极2 H2+4 OH--4e-==4 H2O
正极O2+2H2O+4e-==4 OH-
[变式训练]
(1)把电解质溶液改为稀H2SO4,电极反应式
(2)把H2改为CH4,电解质溶液为KOH溶液,电极反应式
(3)把H2改为CH4,电解质溶液为稀H2SO4溶液,电极反应式
[小结]书写原电池电极反应式的基本思路:
(2)对于有H、O参与的电极反应:
①总反应式中没有H+或OH-参与反应,则若一极消耗H+或OH-,另一极必生成H+或OH-
②H2在酸性介质中放电生成H+,在碱性介质中放电,与OH-结合生成H2O
O2在酸性介质中放电与H+结合生成H2O,在碱性介质中放电生成OH-
③氢氧不够,水来凑
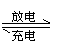 [例题5](05苏14) 高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为
[例题5](05苏14) 高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为
3Zn + 2K2FeO4 + 8H2O 3Zn(OH)2 + 2Fe(OH)3 + 4KOH
下列叙述不正确的是 (AD)
A.放电时负极反应为:Zn-2e- +2OH-= Zn(OH)2
B.充电时阳极反应为:Fe(OH)3 -3e- + 5 OH- = FeO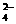 + 4H2O
+ 4H2O
C.放电时每转移3 mol电子,正极有1mol K2FeO4被氧化
D.放电时正极附近溶液的碱性增强
点拨:(1)新型电池的电极判断、电极反应式书写判断等问题仍紧扣原电池原理;
(2)解决“可充电电池”有关问题时,弄清是“充电”还是“放电”,充电为电解池,放电为原电池。
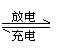 [反馈练习]镊铬(Ni--Cd)可充电电池在现代生活中有广泛应用。它的充放电过程按式进行:Cd(OH)2+2 Ni(OH)2
Cd+ NiO(OH)+2H2O。由此可知,该电池放电时的负极材料是
[反馈练习]镊铬(Ni--Cd)可充电电池在现代生活中有广泛应用。它的充放电过程按式进行:Cd(OH)2+2 Ni(OH)2
Cd+ NiO(OH)+2H2O。由此可知,该电池放电时的负极材料是
A、Cd(OH)2 B、Ni(OH)2
C、Cd D、NiO(OH)
2.A中电子流向:
[小结]:负极:氧化反应
正极:还原反应(溶液中易得电子阳离子得电子)Ag+>Cu2+>H+

 电子流向:负极 导线 正极
电子流向:负极 导线 正极
[例题1]对下图中装置加以必要的连接并填空:
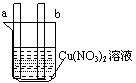
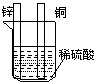
A B
(1)在A图中,使铜片上冒H2气泡.请加以必要连接,连接后的装置叫 。电极反应式: 锌板铜板:
(2)图B中,ab为惰性电极,使a极板上析出铜,则b极板上析出
加以必要的连接后,该装置叫 。电极反应式:a极
B极 。
[变式训练]
1.将A中稀H2SO4改为CuSO4溶液,写出电极反应式
4.(★★★★★)已知在一定条件下C==C可被KMnO4(H+)(aq)氧化、羰基可与乙炔发生反应:
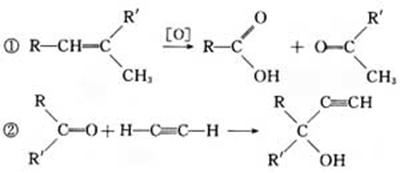
下列系列反应中,B是生活中常见的有机酸:

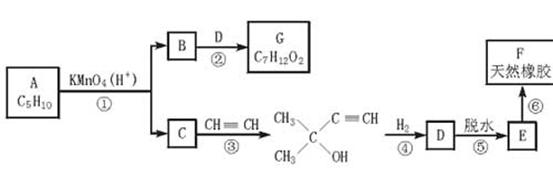
试写出:
(1)A的结构简式____________。
(2)下列反应方程式:B G
;
G
;
E F
。
F
。
3.(★★★★)以乙烯为初始反应物可制得正丁醇(CH3CH2CH2CH2OH)。已知两个醛分子在一定条件下可以自身加成。下式中反应的中间产物(Ⅲ)可看成是由(Ⅰ)中的碳氧双键打开,分别跟(Ⅱ)中的2-位碳原子和2-位氢原子相连而得:(Ⅲ)是一种3-羟基醛,此醛不稳定,受热即脱水而生成不饱和醛(烯醛):
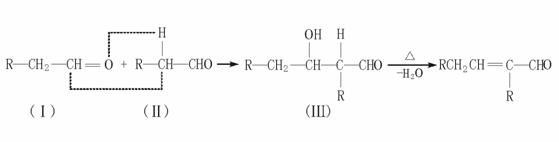
请运用已学过的知识和上述给出的信息写出由乙烯制正丁醇各步反应的化学方程式(不必写出反应条件)。
2.(★★★★)下面列出了8种有机物的转换关系:
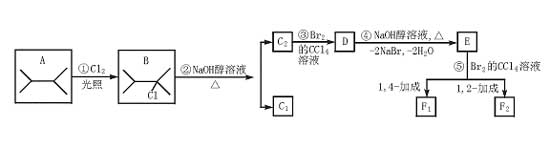
试写出:
(1)C1的结构简式____________,F1的结构简式____________。
(2)①反应方程式___________________,④反应方程式__________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com