
题目列表(包括答案和解析)
23.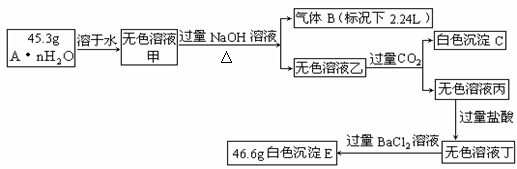 (14分)复盐A·nH2O中含有两种阳离子和一种阴离子,且知有下列变化关系:
(14分)复盐A·nH2O中含有两种阳离子和一种阴离子,且知有下列变化关系:
请回答下列问题:
⑴A·nH2O中含有三种离子是_____________、_____________、____________,A·nH2O的化学式____________________。
⑵白色沉淀C既可以看成是三元弱碱,也可以看成是一元弱酸。写出无色溶液乙与过量的CO2反应生成白色沉淀C的离子方程式:
_____________________________________________________________。
⑶在溶液丁中加入过量的BaCl2溶液后,在称量所的沉淀质量前需要进行的操作依次是___________________________________________,如何判断BaCl2溶液已经过量______________________________________________________________________。
22.(10分)以下是周期表中短周期元素的电负性数据。
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0.98 |
1.57 |
|
|
|
|
|
|
|
a 2.04 |
b 2.55 |
c |
d 3.44 |
e 3.98 |
|
|
f 0.93 |
g 1.48 |
|
|
|
|
|
|
|
h 1.61 |
1.90 |
2.19 |
i 2.58 |
j 3.16 |
|
⑴电负性越大,表示该元素原子越 (填“难”或“易”)形成阴离子。
⑵一般来讲,两元素的电负性差值大于1.7时,形成离子键;小于1.7时,形成共价键,则h、d组成的化合物属 化合物。
⑶b和i以原子个数比为1:2形成的化合物为A,A是________(填“极性分子”或“非极性分子”)。
⑷a-j中两种元素组成的化合物或单质,在某隔热的密闭容器中反应示意图如下。I表示反应前的分子状况,Ⅱ表示容器温度不再升高的分子状态,●和○分别表示不同的原子。
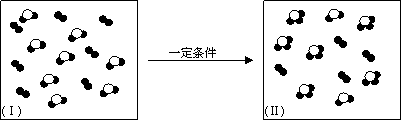
该反应的化学方程式为(不必注明反应条件) 。
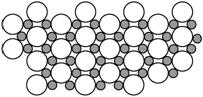 ⑸2001年3月发现a和g形成的化合物在39 K时呈超导性,可能是人类对超导认识的新里程碑。在该晶体的理想模型中,a原子和g原子是分层排布的,一层a一层g的相间排列,右图是该晶体微观空间中取出的部分原子沿Z轴方向的投影,白球是g原子投影,黑球是a原子投影,图中的a原子和g原子投影在同一平面上。根据右图确定该化合物的化学式为_____________。
⑸2001年3月发现a和g形成的化合物在39 K时呈超导性,可能是人类对超导认识的新里程碑。在该晶体的理想模型中,a原子和g原子是分层排布的,一层a一层g的相间排列,右图是该晶体微观空间中取出的部分原子沿Z轴方向的投影,白球是g原子投影,黑球是a原子投影,图中的a原子和g原子投影在同一平面上。根据右图确定该化合物的化学式为_____________。
21.(8分)X、Y、Z、W是原子序数依次增大的短周期元素,且互不同族,其中只有X和Y为金属,X原子的最外层电子数与次外层电子数相等,X与W、Y与Z这两对原子的最外层电子数之和均为9。单质Y和W都可与NaOH溶液反应。
请回答下列问题:
⑴Y、Z、W形成的单核离子半径由小到大的顺序是______________。(用微粒符号回答)
⑵ZW2的结构式是______________,已知它在常温下呈液态,你认为ZW2形成晶体时,属于_________晶体。
⑶X与Y化学性质相似,则X与NaOH溶液反应的化学方程式是:
___________________________________________________________。
⑷0.1 mol的单质W与50 mL 1.5 mol/L的FeBr2溶液反应,则被氧化的Fe2+和Br-的物质的量之比是_________________。
20.(6分)在很长的一个历史时期,人们一直认为氟的含氧酸不存在。1971年美国科学家用F2通过细冰,获得次氟酸(HFO),对次氟酸的研究引起充分重视。
请回答:
⑴次氟酸的电子式为 ,次氟酸中F的化合价为________。
⑵次氟酸能与水反应得到溶液A,A中含有B、C二种溶质。B是一种非常稳定的化合物,C在MnO2催化作用下能迅速分解生成可使带火星的木条复燃的气体。次氟酸与水反应的化学方程式为 。
19.(10分)⑴配平以下氧化还原反应方程式:
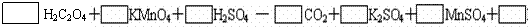
 当KMnO4消耗0.05 mol时,得到的氧化产物的物质的量为__________,转移电子的数目为_______________。
当KMnO4消耗0.05 mol时,得到的氧化产物的物质的量为__________,转移电子的数目为_______________。
⑵家用液化气中主要成份之一是丁烷,当10 kg丁烷完全燃烧并生成二氧化碳和液态水时,放出热量5×105 kJ,试写出丁烷燃烧反应的热化学方程式:
。
已知1 mol液态水气化时需要吸收44 kJ热量,则0.5 mol丁烷完全燃烧产生气态水时放出的热为 kJ。
18.(14分) 某校开展从废旧干电池中回收碳棒、MnO2、NH4Cl、ZnCl2等物质课外研究性学习活动,整个过程如下:
⑴干电池工作时正板上的反应是NH4++e-=NH3+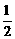 H2,该电极反应属于
反应(选填“氧化”或“还原”),MnO2的作用是除去正极上的产物,本身生成Mn2O3,该反应的化学方程式是
。
H2,该电极反应属于
反应(选填“氧化”或“还原”),MnO2的作用是除去正极上的产物,本身生成Mn2O3,该反应的化学方程式是
。
⑵锌皮和碳棒的回收:用钳子和剪子剪开回收的干电池的锌筒,将锌皮和碳棒取出,刷洗干净,将电池内的黑色粉末移入小烧杯中。
⑶氯化铵、氯化锌的提取、检验
①向小烧杯中加入一定量的热蒸馏水,充分搅拌, ,所得晶体即为ZnCl2、NH4Cl。
②设计简单的实验证明所得晶体中含有NH4+和Zn2+,并填写下列实验报告。
|
实验步骤 |
实验现象 |
实验结论 |
有关离子方程式 |
|
第一步:取少量晶体溶于蒸馏水配成溶液 |
  |
|
 |
|
第二步: |
|
说明有NH4+ |
|
|
第三步:取少许溶液,加适量氨水,将悬浊液分成两份,一份加稀HCl,一份加足量NaOH溶液。 |
先生成白色沉淀,后沉淀都溶解 |
说明有Zn2+ |
 |
有同学提出第三步Zn2+的检验所得结论不可靠,其原因是
。
17.(8分)亚硫酸根离子和二氧化硫中硫元素都是+4价。为了说明亚硫酸根离子既有氧化性又有还原性,请从提供的试剂中选择必要的药品,进行最简捷而现象鲜明的实验。
提供试剂:A.Na2SO3溶液 B.Na2S溶液 C.稀硫酸 D.NaOH溶液 E.溴水
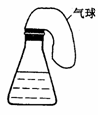 (注:以下选择的试剂,可以是2种或2种以上,但要符合题意)
(注:以下选择的试剂,可以是2种或2种以上,但要符合题意)
⑴要证明 的化合物具有还原性,选择的试剂______________(填序号)。
的化合物具有还原性,选择的试剂______________(填序号)。
⑵若要用右图装置证明 的化合物具有氧化性,选择的试剂是
的化合物具有氧化性,选择的试剂是
________________ (填序号),锥形瓶溶液中观察到的现象是_____________。
若气球保持常态,反应的离子方程式是_________________________________。
16.下表中的陈述I、Ⅱ均正确性,且具有因果关系的是
|
选项 |
陈
述 I |
陈
述 Ⅱ |
|
A |
K元素的金属性比Na强 |
K的密度比Na大 |
|
B |
在空气中Al比Fe更耐腐蚀 |
Fe比Al更容易失电子 |
|
C |
NaCl晶体中没有自由移动的离子 |
NaCl晶体不导电 |
|
D |
FeCl3溶液能与Cu单质反应 |
用FeCl3溶液腐蚀制印刷电路板 |
第Ⅱ卷(非选择题 共86分)
15.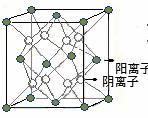 如图为CaF2晶体的一个晶胞(晶体中最小的重复单元)。则下列说法正确的是
如图为CaF2晶体的一个晶胞(晶体中最小的重复单元)。则下列说法正确的是
A.每个晶胞含有4个Ca2+和8个F-
B.晶体中与阳离子等距离且最近的阴离子个数为4
C.该晶体中的阴阳离子最外层均达8电子结构
D.该晶体中阳离子半径小于阴离子半径
14.下列各组离子一定能大量共存的是
A.在含大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN-
B.在强碱溶液中:Na+、K+、MnO4-、NO3-
C.在由水电离出的c(H+) =10-13mol/L 的溶液中:NH4+、Al3+、SO42-、NO3-
D.在无色透明溶液中:K+、AlO2-、Cl-、HCO3-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com