
题目列表(包括答案和解析)
17.(14分)空气中的SO2含量和可吸入颗粒的含量(可用g/cm3表示)都是重要的空气质量指针。在工业生产上规定:空气中二氧化硫的最大允许排放浓度不得超过0.02mg/L。
⑴为测定某地方的空气中SO2和可吸入颗粒的含量,甲同学设计了如下图所示的实验装置:

①应用上述装置测定空气中的SO2含量和可吸入颗粒的含量,除测定气体流速(单位:cm3/min)外,还需要测定 。
②已知:碘单质微溶于水,KI可以增大碘在水中的溶解度。
请你协助甲同学完成100mL5×10-4mol/L碘溶液的配制:
第一步:准确称取1.27g碘单质加入烧杯中, ;
第二步: ;
 第三步:从第二步所得溶液中,取出10.00mL溶液于100mL容量瓶中,加水稀释至刻度线。
第三步:从第二步所得溶液中,取出10.00mL溶液于100mL容量瓶中,加水稀释至刻度线。
⑵乙同学拟用下列简易装置测定空气中的SO2含量:准确移取50mL5×10-4mol/L的碘溶液,注入右图所示广口瓶中,加2-3滴淀粉指示剂,此时溶液呈蓝色。在指定的测定地点抽气,每次抽气100mL,直到溶液的蓝色全部褪尽为止,记录抽气次数(n)。
①假设乙同学的测量是准确的,乙同学抽气的次数至少为 次,方可说明该地空气中的SO2含量符合排放标准。
②如果乙同学用该方法测量空气中SO2的含量时,所测得的数值比实际含量低,请你对其可能的原因(假设溶液配制、称量或量取及各种读数均无错误)提出合理假设:_______________________________________________________________。
③丙同学认为:乙同学的实验方案需要抽气的次数太多,操作麻烦。与乙讨论后,决定将抽气次数降到100次以下,请你设计合理的改进方案:
。
⑶改变合适的吸收液,乙同学使用的装置还可以测定新装修的居室空气中甲醛的浓度,吸收剂最好选用 (选填:①浓硫酸、②银氨溶液、③新制的氢氧化铜、④酸化的高锰酸钾溶液)。
16.(8分)⑴下列实验设计或操作合理的是_____________。
a.中和热测定实验时,如果没有环形玻璃棒,可用环形铜质搅拌棒代替。
b.实验室制肥皂时,将适量植物油、乙醇和NaOH溶液混合,并不断搅拌、加热,直到混合物变稠,即可得到肥皂。
c.实验室制取乙烯时必须将温度计的水银球插入反应液中,测定反应液的温度。
d.向Na2CO3与NaOH的混合溶液中加入足量的CaCl2溶液,再滴加几滴酚酞试液,可检验NaOH的存在。
e.将10滴溴乙烷加入1mL10%的烧碱溶液中加热片刻后,再滴加2滴2%的硝酸银溶液,以检验水解生成的溴离子。
⑵某研究性学习小组拟用明矾制取Al2(SO4)3晶体和K2SO4晶体。
①实验室除明矾外,已备好的用品有蒸馏水、氨水、pH试纸,还缺少的试剂有 。
②制得Al2(SO4)3与K2SO4物质的量之比小于 。
15.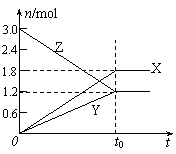 在一定温度下,将等量的气体分别通入起始体积相同的密闭容器Ⅰ和Ⅱ中,使其发生反应,t0时容器Ⅰ中达到化学平衡,X、Y、Z的物质的量的变化如图所示。则下列有关推断正确的是
在一定温度下,将等量的气体分别通入起始体积相同的密闭容器Ⅰ和Ⅱ中,使其发生反应,t0时容器Ⅰ中达到化学平衡,X、Y、Z的物质的量的变化如图所示。则下列有关推断正确的是

 A.该反应的化学方程式为:3X+2Y 2Z
A.该反应的化学方程式为:3X+2Y 2Z
B.若两容器中均达到平衡时,两容器的体积V(Ⅰ)<V(Ⅱ),则容器Ⅱ达到平衡所需时间大于t0
C.若两容器中均达到平衡时,两容器中Z的物质的量分数相同,则Y为固态或液态
D.若达平衡后,对容器Ⅱ升高温度时其体积增大,说明Z发生的反应为吸热反应
第Ⅱ卷(非选择题 共90分)
14.气态中性原子失去一个电子转化为气态正离子所需要的最低能量叫做第一电离能(I1),气态正离子继续失去电子所需最低能量依次称为第二电离能(I2)、第三电离能(I3)……下表是第三周期部分元素的电离能[单位:eV(电子伏特)]资料。
|
元素 |
I1/eV |
I2/eV |
I3/eV |
|
甲 |
5.7 |
47.4 |
71.8 |
|
乙 |
7.7 |
15.1 |
80.3 |
|
丙 |
13.0 |
23.9 |
40.0 |
|
丁 |
15.7 |
27.6 |
40.7 |
下列说法正确的是
A.甲的金属性比乙强 B.乙的化合价为+1价
C.丙可能为非金属元素 D.丁一定是金属元素
13.对下列各种溶液中所含离子的判断合理的是
A. 向无色溶液中加氯水变橙色,溶液中可能含: SO42-,Br-,OH-,Ba2+
B.在c(H+)=10-14mol/L的溶液中可能含:Na+,A102-,CO32-,SO32-
C. 某溶液,加铝粉有氢气放出,则溶液中可能含:K+,Na+,H+,NO3-
D.使紫色石蕊试液变红色的溶液中可能含:K+,Na+,Ca2+,HC03-
12. 下列是爱迪生电池分别在充电和放电时发生的反应:
下列是爱迪生电池分别在充电和放电时发生的反应:
Fe+NiO2+2H2O Fe(OH)2 + Ni(OH)2
下列关于爱迪生电池推断错误的是
①放电时,Fe参与负极反应,NiO2参与正极反应
②充电时,阴极上的电极反应式为:Fe(OH)2 +2e-== Fe +2OH-
③放电时,电解质溶液中的阴离子向正极方向移动
④放电时,负极上的电极反应式为:Fe+2H2O-2e-== Fe(OH)2 +2H+
⑤蓄电池的电极必须浸入某种碱性电解质溶液中
A.只有③ B.③④ C.④⑤ D.①②⑤
11.已知HF比CH3COOH易电离。关于物质的量浓度、体积都相同的NaF溶液和CH3COONa溶液,下列说法正确的是
A.CH3COONa溶液中:c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
B.在相同条件下,两溶液的pH大小为: CH3COONa< NaF
C.NaF溶液中:c(H+)+c(HF)= c(OH-)
D.两溶液相比较,NaF溶液中的离子总数较少
10.阿伏加德罗常数约为6.02×1023 mol-1,下列叙述正确的是
A.标准状况下,1.12L的SO3所含的原子数约为0.2×6.02×1023
B.在标准状况下,2.24L一氧化氮与氮气混合气所含分子数约为0.1×6.02×1023
C.1molCH3+(碳正离子)中含电子数目约为10×6.02×1023
D.1molD2O含有的中子数约为8×6.02×1023
9.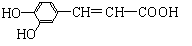 咖啡酸具有止血、镇咳、祛痰等疗效,其结构简式为
。
咖啡酸具有止血、镇咳、祛痰等疗效,其结构简式为
。
下列有关咖啡酸的说法中,不正确的是
A.咖啡酸可以发生还原、取代、加聚等反应
B.咖啡酸与FeCl3溶液可以发生显色反应
C.1 mol咖啡酸可与4 mol H2发生加成反应
D.1 mol咖啡酸最多能消耗3 mol的NaHCO3
8.下列离子方程式正确的是
A.用两个铜电极电解稀盐酸:2Cl-+2H+ H2↑+C12↑
H2↑+C12↑
B.向硅酸钠溶液中通入过量的CO2: SiO32- + 2CO2 + 2H2O = H2SiO3↓+ 2HCO3-
C.过量铁粉与一定量稀硝酸反应:Fe+4H++NO3-=Fe3++NO↑+2H2O
D.向NH4HSO4稀溶液中逐滴加入Ba(OH)2稀溶液至刚好沉淀完全:
Ba2+ + 2OH- + NH4+ +H+ + SO42- = BaSO4↓+ NH3·H2O + H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com