
题目列表(包括答案和解析)
3. 下列叙述正确的是( )
A. 共价化合物中各原子都形成8电子稳定结构
B. 物质导电均为物理变化
C. 两种元素组成的离子化合物中一定不含非极性键
D. 由一种分子构成的物质一定是纯净物
2. 下列说法不正确的是( )
A. 胶体能发生电泳现象是由于胶体粒子带电
B. 16O与18O互为同位素;H216O、D216O互为同素异形体
C. 在SiO2晶体中,1个Si原子和4个O原子形成4个共价键
D. 工业制硫酸的主要设备按反应先后依次是沸腾炉、接触室、吸收塔
1. 下列实际应用与胶体知识无关的是( )
A. 工业制取有色玻璃 B. 明矾净水
C. 冶金工业用高压电除尘 D. 离子交换膜法制烧碱
24.(10分)氢气还原氧化铜的反应不完全时,便得到Cu、Cu2O、CuO的固体混合物。化学兴趣小组同学为探究上述固体的成分进行了如下操作和实验:
(1)取一定质量的均匀固体混合物A,将其分成两等份。
(2)取其中-份用足量的氢气还原,测得反应后固体质量减少3.20g。
(3)另一份加入500mL稀硝酸,固体恰好完全溶解,且同时收集到标准状况下NO气体2.24L。
请回答以下问题:
(1)A中,n(Cu)+n(Cu2O)= 。
(2)A中,n(CuO)的取值范围是 。
(3)试计算所用稀硝酸的物质的量浓度。
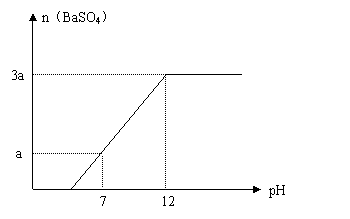
23、(8分)向盛有V LNaHSO4和Na2SO4混合溶液的烧杯中不断加入Ba(OH)2溶液,当沉淀量达到最大值时,溶液的总体积为2VL。溶液中产生沉淀的物质的量与溶液的pH变化如图。求原溶液中NaHSO4、Na2SO4 及所加Ba(OH)2三者的物质的量浓度。
22.(12分)2005年的诺贝尔化学奖颁给了在烯烃复分解反应研究方面做出突出贡献的3位化学家。烯烃复分解反应实现了在一定条件下烯烃中碳碳双键两边基团的换位。
如:2CH2=CHCH2CH3 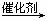 CH2=CH2 + CH3CH2CH=CHCH2CH3。
CH2=CH2 + CH3CH2CH=CHCH2CH3。
又已知:两个醛分子在一定条件下可以发生加成反应:

现仅以丙烯为有机原料,经过下列反应可以分别合成重要的化工原料F和K,以F和K为原料可合成一种链状高分子化合物M,其化学组成为(C12H20O4)n。
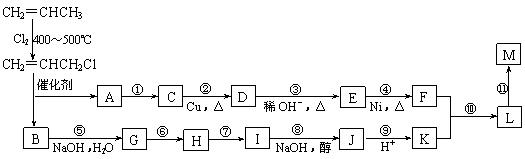
回答下列问题:
⑴反应①的反应类型是:_________________。
⑵反应⑥、⑦中有一反应是与HCl加成,该反应是_____(填反应编号),设计这一步反应的目的是_____________________________________________________。
⑶物质M的结构简式为:______________________________________。
⑷写出下列反应的化学方程式:
反应⑧:_____________________________________________________________;
反应⑩:_____________________________________________________________。
21.(8分) 有A、B、C均是由碳、氢、氧三种元素组成的有机物,它们的相对分子质量相等,但碳原子数依次减少一个。已知
① 2.6g液态A在0.175mol氧气中,经点燃后两者均确好完全反应得到2.8L二氧化碳(标准状况)和液态水。
② A不能发生消去反应,1molA与足量的钠反应能生成1mol H2 。能与C发生缩聚生成聚酯D
③ B的溶液显酸性,分子中无甲基,一定条件下分子内部可脱水生成环状物E。
完成下列问题:
(1)A的结构简式为: ;C的结构简式为: ;E的结构简式为: 。
(2)与B属于同类物质的B同分异构体(不包括B)有 种。
20.(12分)化学在能源开发与利用中起着十分关键的作用。
⑴蕴藏在海底的“可燃冰”是高压下形成的外观像冰的甲烷水合物固体,我国南海海底有极其丰富的“可燃冰”资源。
①将“可燃冰”从海底取出,“可燃冰”将融化并放出甲烷气体。请你所学的物质结构知识加以解释: 。
②取356g分子式为CH4·9H2O的“可燃冰”,将其释放的甲烷完全燃烧生成液态水,可放出1780.6kJ的热量,则甲烷的燃烧热为 。
⑵设计出燃料电池使液化石油气氧化直接产生电流是新世纪最富有挑战性的课题之一。最近有人制造了一种燃料电池,一个电极通入空气,另一电极通入液化石油气(以C4H10表示)电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-离子。
①已知该电池的负极反应为C4H10+13O2――26e―=4CO2+5H2O,则该电池的正极反应式为 ,电池工作时,固体电解质里的O2-向 极移动。
②液化石油气燃料电池最大的障碍是氧化反应不完全而产生的 (填写物质的名称)堵塞电极的气体通道。
⑶能源的紧缺在很大程度上制约了我省的经济发展,请你提出解决江苏省能源紧缺问题的两点建议 。
19.(10分) 下图为某些常见物质之间的转化关系。已知:A、B、I中含有相同的阳离子且都是XY2型化合物,I是常用的干燥剂,C为直线型分子。
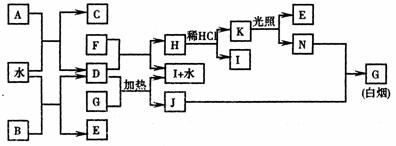
请按要求填空:
(1)B的电子式是 ,K的结构式是 ;
(2)D与G反应的化学方程式是 ;
(3)已知C的燃烧热是1300kJ/mol,表示C的燃烧热的热化学方程式是 ;
(4)单质F与D的反应在工业上有重要的用途,其化学方程式是 。
18.(8分)下表是三个不同短周期部分元素的原子半径及主要化合价:
|
元素代号 |
W |
R |
X |
Y |
Z |
|
原子半径/nm |
0.037 |
0.157 |
0.066 |
0.070 |
0.077 |
|
主要化合价 |
+1 |
+1 |
-2 |
-3,+5 |
+2、+4 |
试回答下列问题:
⑴五种元素中原子半径最大的元素在周期表中位于 。
⑵写出下列有关反应的化学方程式:
①Z的单质与Y元素的最高价氧化物对应的水化物反应: ;
②R2X2与ZX2反应: 。
⑶X可与Z形成一种有恶臭味的气体,该气体与氧气发生反应的物质的量之比为1:2,且反应前后气体的总体积不变,试写出该气体分子(分子中各原子最外层均满足8e-结构,且含有非极性键)的电子式 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com