
题目列表(包括答案和解析)
23. 工业用接触法制硫酸,请回答下列问题:
(1)接触室中生成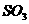 反应条件的选择,可以完全用勒夏特列原理解释的是______。
反应条件的选择,可以完全用勒夏特列原理解释的是______。
A. 用V2O5作催化剂 B. 温度为400℃-500℃
C. 常压 D. O2过量
(2)在硫酸工业的尾气中,__________是主要大气污染物,必须进行净化处理,处理方法可用过量氨水吸收,反应的离子方程式是______________________________。
(3)用含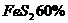 的黄铁矿100t,如果在锻烧过程中
的黄铁矿100t,如果在锻烧过程中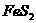 损失了18%,则可生产质量分数为98%的硫酸多少吨?请写出计算步骤。
损失了18%,则可生产质量分数为98%的硫酸多少吨?请写出计算步骤。
22. 利用下列所给实验用品:①Fe电极②石墨电极③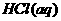 ④
④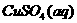 ⑤
⑤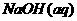 ⑥导线⑦直流电源(负极在左,正极在右),各设计一种能够实现下列反应的装置(相关内容请用序号填空):
⑥导线⑦直流电源(负极在左,正极在右),各设计一种能够实现下列反应的装置(相关内容请用序号填空):
(1)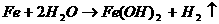
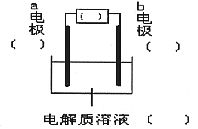
(2)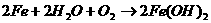

21. X、Y、Z、W为按原子序数由小到大排列的四种短周期元素。
已知:①X可分别与Y、W形成X2Y,X2Y2、XW等共价化合物。
②Z可分别与Y、W形成Z2Y、Z2Y2、ZW等离子化合物。
请回答:
(1)Z2Y的电子式是______________________________________________________;
(2)Z2Y2与X2Y反应的化学方程式是____________________________________;
(3)ZW晶体的单元结构如下图所示,晶体中距离最近的Z+和W-的核间距离a cm,已知阿伏加德罗常数为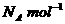 ,其密度为
,其密度为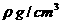 ,则ZW的摩尔质量可表示为__________g/mol;
,则ZW的摩尔质量可表示为__________g/mol;
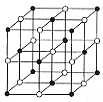
(4)如下图所示装置,两玻璃管中盛满滴有酚酞溶液的ZW饱和溶液,C(I)、C(II)为多孔石墨电极。接通S1后,C(I)附近溶液变红,两玻璃管中有气体生成。此时:

C(I)为________极,该电极反应式为____________________,
电解的总反应的离子方程式为____________________;
(5)接通S1一段时间后(两玻璃管中液面未脱离电极),断开S1,接通S2,电流表的指针发生偏转。此时:
C(I)为__________极,
C(II)的电极反应式为______________________________。
20. 某一反应体系有反应物和生成物共五种物质:
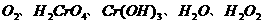
已知该反应中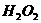 只发生如下过程:
只发生如下过程: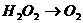
(1)该反应中的还原剂是_________;
(2)该反应中,发生还原反应的过程是__________________→__________________;
(3)写出该反应的化学方程式,并标出电子转移的方向和数目__________________;
(4)如反应转移了0.3 mol电子,则产生的气体在标准状况下体积为_________L。
19. 有一瓶澄清溶液,其中可能含有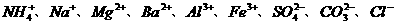 和
和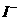 。取该溶液进行如下实验:
。取该溶液进行如下实验:
①用pH试纸检验,溶液呈强酸性
②取部分溶液,加入少量CCl4及数滴新制的氯水,振荡后静置,CCl4层呈紫红色
③另取部分溶液,逐滴加入稀氢氧化钠溶液,使溶液从酸性逐渐变为碱性,在滴加过程中及滴加完毕后,溶液中均无沉淀生成
④取上述碱性溶液,加入碳酸氢钠溶液,有白色沉淀生成
⑤将③得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝
根据上述实验事实确定:
(1)该溶液中肯定存在的离子有__________________。
(2)不能确定是否存在的离子有__________________。
18. 通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可以估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与形成新化学键的键能之和的差。
|
化学键 |
Si-F |
Si-Cl |
H-H |
Cl-Cl |
H-Cl |
Si-Si |
Si-C |
|
键能/kJ·mol-1 |
540 |
360 |
436 |
243 |
431 |
176 |
347 |
已知硅的卤化物(SiX4)的熔点比钠的卤化物(NaX)的熔点低得多。
请回答下列问题:
(1)比较下列两组物质的熔点高低(填“>”或“<”)
SiC_________Si;SiF4_________SiCl4;
(2)下图立方体中心的“●”表示硅晶体中的一个原子,请在立方体的顶点用“●”表示出与之紧邻的硅原子;
(3)工业上可通过氢气和氯气点燃来制取氯化氢,写出该反应的热化学方程式_____________________________________________。
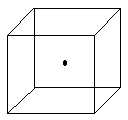
17. 化合物A是一种不稳定的物质,可以用 表示,10mL A(g)能分解生成15mL O2和10mL F2(同温同压下),由此可以推断:
表示,10mL A(g)能分解生成15mL O2和10mL F2(同温同压下),由此可以推断:
(1)A的化学式为_________,推断的依据是:__________________;
(2)已知A的分子中的X个原子呈…O-O-O…键状排列,则A分子的电子式为__________________。
16. 按下图进行实验,写出有关的电极反应式:
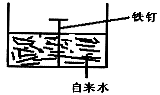
负极_________________,正极__________________。
15. 高铁电池是一种新型可充电电池,与普通高能电池相比,该电池长时间保持稳定的放电电压。高铁电池的总反应为:
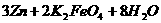
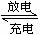
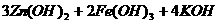
下列叙述不正确的是( )
A. 放电时负极反应为: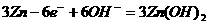
B. 充电时阳极反应为: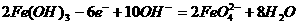
C. 放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化
D. 放电时阴离子向负极移动
14. 用石墨作电极电解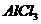 溶液时,下图所示的电解液变化曲线中合理的是(不考虑
溶液时,下图所示的电解液变化曲线中合理的是(不考虑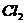 的溶解对溶液pH的影响)( )
的溶解对溶液pH的影响)( )

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com