
题目列表(包括答案和解析)
25、(8分)某结晶水合物含有两种阳离子和一种阴离子。称取两份质量均为1.96g的该结晶水合物,分别制成溶液。一份加入足量Ba(OH)2溶液,生成白色沉淀,随即沉淀变为灰绿色,最后带有红褐色;加热该混合物,逸出能使湿润的红色石蕊试纸变蓝的气体;用稀盐酸处理沉淀物,经洗涤和干燥,得到白色固体2.33 g。另一份加入含0.001 molKMnO4的酸性溶液,MnO4-恰好完全被还原为Mn2+。
请回答以下问题:
(1)该结晶水合物中含有的两种阳离子是 和 ,阴离子
是 。
(2)试通过计算确定该结晶水合物的化学式。
24、(8分)(1)已知下列反应在一定条件下可以发生:
H2O2+ 2Fe2++2H+=2Fe3++ 2H2O H2O2+2Fe3+=2Fe2++ O2↑+2H+
在以上反应中Fe2+实际上起着 作用,总反应式为
(2) I2与Fe2+一样发生上述类似反应,类比(1)在下面填入配平的合适的化学反应方
程式:H2O2+I2=2HIO, ,总反应式为
(3)在硫酸和KI的混合溶液中加入足量的H2O2,放出大量的无色气体,溶液呈棕色,并可使淀粉变蓝色。有学生认为该反应的离子方程式为:H2O2+2I-= O2↑+2H++I2,这个方程式正确吗?若正确,理由是(若认为不正确,该步不必作答) 。
若不正确,原因是(若认为正确,该步不必作答) ,并写出正确的化学反应方程式为(若是离子反应,写出离子反应方程式,没有离子
反应的,写出化学反应方程式)
23、(14分)已知X、Y、Z、W四种元素是元素周期表中连续三个不同短周期的元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子最外层电子数之和。Y的氢化物分子中有3个共价键。Z原子最外层电子数是次外层电子数的3倍。试推断:
(1)X、Z、二种元素的符号:X 、Z
(2)由以上元素中的两种元素组成的能溶于水且水溶液显碱性的化合物的电子式分别
为:
(3)由X、Y、Z所形成的常见离子化合物是 .
它与W的最高氧化物的水化物的浓溶液加热时反应的离子方程式是:
。
(4)在由X、Y、Z、W四种元素形成的常见单质或化合物中,不能形成的晶体类型是 。
22、(12分)室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适反应条件下,它们可以按下面框图进行反应,又知E溶液是无色的,请回答:
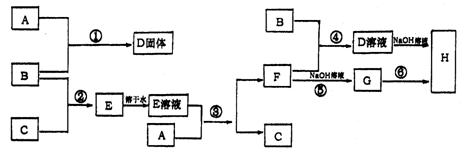
(1)A是 ,B是 ,C是 (填化学式)
(2)反应⑥的化学方程式为: 。
(3)反应④的离子方程式为: 。
(4)写出D的溶液与A反应的离子方程式: 。
21、(10分)二氯化硫(SCl2)熔点-78℃,沸点59℃。密度1.638。遇水易分解。二氯化硫与三氧化硫作用可生成重要化工试剂亚硫酰氯(SOCl2)。以下是由氯气与硫反应合成二氯化硫的实验装置。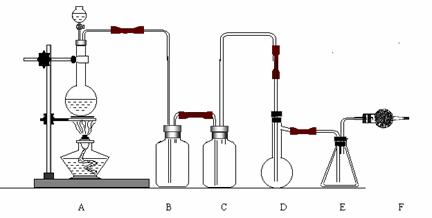
试回答下列问题:
(1)装置A中发生反应的化学方程式为: 。
(2)装置C盛放的药品是 。
(3)实验开始前先在D中放入一定量的硫粉,加热使硫熔化,然后转动和摇动烧瓶使硫附
着在烧瓶内壁形成一薄层表面,这样做的目的是 。
(4)实验时,D装置需加热至50-59oC,最好采用何种方式 加热 。
(5)F装置中干燥管内所盛物质的作用是:
20、(8分)根据实验室中测定硫酸铜晶体结晶水含量的实验,填写下列空白:
(1)从下列仪器中选出所需仪器(用标号字母填写)____ ____ 。
A.托盘天平(带砝码) B.研钵 C.试管夹 D.酒精灯 E.蒸发皿 F.玻璃棒 G.坩埚 H.干燥器 I.石棉网 J.三脚架
除上述仪器外,还需要的仪器是______ 。
(2)某学生实验后得到以下数据
|
加热前质量 |
加热后质量 |
|
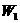 (容器) (容器) |
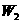 (容器+晶体) (容器+晶体) |
 (容器+无水硫酸铜) (容器+无水硫酸铜) |
|
5.4g |
7.9g |
6.8g |
该学生测定结果是偏高还是偏低?____ _____,从下列分析中进行选择,该学生实验误
差的原因可能是(填写字母)___ ____。
A.加热前称量时容器未完全干燥 B.最后两次加热后的质量相差较大(大于0.1g)
C.加热后容器未放入干燥器中冷却 D.加热过程中有少量晶体溅失
19、(6分)下列有关实验的叙述,正确的是(填序号)
(A)配制500 mL某物质的量浓度的溶液,可用两只250 mL的容量瓶
(B)谜语:“我入水中较安全,水入我中真危险,我与水合多放热,实验牢记保平安。”这一实验操作是指稀释浓硫酸。
(C)无法用分液漏斗将甘油和水的混合液体分离
(D)加入Ba(NO3)2溶液,生成白色沉淀,加稀盐酸沉淀不消失,可确定有SO42-存在
(E)为了测定某溶液的pH,将未经湿润的pH试纸浸入到待测溶液,过一会取出,与标准比色卡进行对比
(F)在烧杯中加入水和苯(密度:0.88g/cm3)各50mL。将一小粒金属钠(密度:0.97g/cm3) 投入烧杯中,所观察到的现象是钠在苯与水的界面处反应并可能作上、下跳动,直至消失。
18、离子反应为a MnO4 - + b I-+ H+→ Mn2++ c I2 + d IO3- + H2O;根据该离子方程式,下列说法正确的是
A. 氧化性MnO4 ->IO3-
B. 如c=d=5,则该反应转移电子数为30e-
C. a、b、c、d之间的关系是:5a=2c +6d;b=2c+d
D. 当反应物的相对量或浓度发生改变时,化学计量数一定有c=d
第Ⅱ卷 (非选择题,76分)
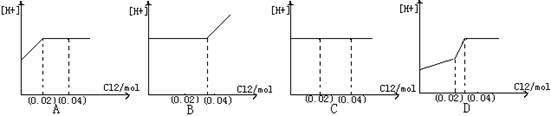
17、将0.03mol Cl2缓缓通入含0.02mol H2SO3和0.02molHBr的溶液中,在此过程中,溶液的[H+]与Cl2用量的关系示意图是(溶液的体积视为不变, 已知:H2SO3 的还原性大于HBr的还原性)( )
16、类推的思维方式在化学学习与研究中经常采用,但类推出的结论是否正确最终要经过实践的验证。以下类推的结论正确的是( )
A.由“Cl2+H2O=HCl+HClO”反应可推出 “F2+H2O =HF+HFO” 反应也能发生
B. NaCl与CsCl化学式相似,故NaCl与CsCl的晶体结构也相似
C.由“2Fe+3Cl2=2FeCl3”反应可推出“2Fe+3I2=2FeI3”反应也能发生
D.Na、K具有强还原性,Na常温下与水剧烈反应,故K常温下也能与水剧烈反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com