
题目列表(包括答案和解析)
24.(18分)提供下列试剂:①蒸馏水、②用硝酸酸化的AgNO3溶液、③熟石灰、④淀粉、⑤肥皂水、⑥食醋、⑦废干电池(锌筒内填有炭粉、MnO2、NH4Cl、淀粉等的糊状物)、⑧NaCl、⑨Na2CO3 。某同学准备进行下列实验:a.制NaOH b.制Cl2并验证其漂白性 c.制CO2气体 d.制硬脂酸 e.进行淀粉的水解实验并检验其水解产物
(1)由于缺少试剂而不能进行的实验是(不考虑电解) (填代号)。
(2)该同学为制备NH3,先从废干电池中制备NH4Cl。为此,他设想将废电池中的混合物溶于少量的水中,过滤除去不溶物,再蒸发和灼烧滤液,以制得干燥的NH4Cl晶体。他的设想是否合理 (填“合理”或“不合理”),其理由是
。
(3)该同学在做除去淀粉溶液中的氯化钠的实验时,他用一枚鸭蛋自制了一个半透膜小袋,向其中装入混有NaCl的淀粉溶液,扎好袋口。他即将进行的实验操作的名称是
;要保证全部除去淀粉溶液里的食盐,实验中必须
。
(4)另有同学设计了实验室制取CO2的如下四种实验原理和装置:

你认为其中最适合本题所提供的条件的实验原理与装置是 ;理由是
。
(5)由于实验(2)中NH4Cl的制备较困难,且难以满足量的要求,现重瓣提供足量的浓氨水、浓NaOH溶液和NH4Cl晶体,请设计一个最简单的实验,以快速制得NH3。
①你设计的方案是
②请运用化学原理对你的方案予以解释
。
23.(6分)实验室分析白铁(镀锌的铁)样品成分,称取1.00 g样品放在烧杯中。加入过量盐酸,然后用玻璃片盖住烧杯,首先观察到大量气体冒出,后来放出气体速率变慢,最后反应完全。接着在反应后的溶液中加入过量的NaOH溶液,过滤分离出灰绿色沉淀,该沉淀在空气中加热至质量不变,最后得到1.20g红色粉末。(已知氢氧化锌是两性氢氧化物)
(1)在铁上镀锌的目的是 ;白铁的镀层损伤后,在潮湿的空气环境中首先被腐蚀的金属是 。
(2)实验中,过滤用到的主要仪器是 ,放出气体速率由快变慢的原因是 。
(3)为什么要加入过量NaOH溶液 。
(4)锌在样品中的质量分数是 。
22.(4分)乙知下列两个热化学方程式;
H2(g)+ O2(g)===H2O(1); △H=-285.kJ/mol
O2(g)===H2O(1); △H=-285.kJ/mol
C3H8(g)+5O2(g)===3CO2(g)+4H2O(1); △H=-2220.0kJ/mol
(1)实验测得H2和C3H8的混合气体共5mol,完全燃烧生成液态水时放热6264.5kJ,则混合气体中H2和C3H8的体积比是 。
(2)已知:H2O(1)=H2O(g);△H=+44.0kJ/mol
写出丙烷燃烧生成CO2和气态水的热化学方程式。
21.(6分)在抗击非典型性肺炎期间,过乙酸(过氧乙酸)曾被广泛用作消毒剂。
已知硫酸和过硫酸的结构简式如下:
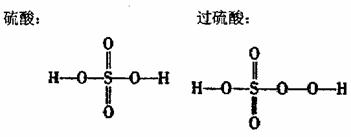
请从以下八个式中选择答案中回答下列问题(答案用编号表示,选错要倒扣分)。

(1)过乙酸(过氧乙酸)的结构简式是 。
(2)过乙酸的同分异构体是 。
(3)过乙酸的同系物是 。
20.(6分)X、Y、Z三种元素位于周期表前20号元素之中。
已知:①XY2加水生成Y2Z2和化合物D;
②X的氧化物加水也生成D;
③Y的氧化物有两种。
请填空:(1)Y的最高价氧化物的电子式为 ,D的电子式为 。
(2)反应①的化学方程式为 。
(3)反应②的化学方程式为 。
19.(8分)按要求回答下列问题:
(1)0.01mol/L的硫酸氢钠溶液的pH为 ,在其中滴入等体积的pH=12的Ba(OH)2溶液后,所发生反应的离子方程式为 。
(2)钢铁在潮湿的空气中生锈,有关的电极反应方程式为:
负极: ,正极: 。
(3)只用一种试剂可能把Fe、FeO、FeS、CuO、C、MnO2六种黑色粉末鉴别出来,该试剂是 ,其中,MnO2与该试剂反应的化学方程式为 。
(4)实验室配制硝酸汞溶液时,须将其晶体溶于稀硝酸中,其原因是 ,所涉及反应的离子方程式为 。
18.将1molCH4和适量的氧气在密闭容器中点燃,充分反应后,甲烷和氧气均无剩余,且产物均为气体(101kPa,120℃),其总质量为72g,下列有关叙述不正确的是 ( )
A.若将产物通过碱石灰,则可全被吸收,若通过浓硫酸,则不能被完全吸收
B.产物的平均摩尔质量为24g/mol
C.若将产物通过浓硫酸充分吸收后恢复至(101kPa,120℃),则压强变为原来的1/3
D.反应中消耗的氧气为56g
第Ⅱ卷 非选择题(共56分)
17.若某电能与化学能的转化装置(电解池或原电池)中发生反应的总反应离子方程式是:
Cu+2H+===Cu2++H2↑,则关开该装置的有关说法正确的是 ( )
A.该装置可能是原电池,也可能是电解池
B.该装置只能是原电池,且电解质溶液为硝酸
C.该装置只能是电解池,且金属铜为该电解池的阳极
D.该装置只能是电解池,电解质溶液不可能是盐酸
16.一定量混合气体在密闭容器中发生如下反应:xA(g)+yB(g)=zC(g);△H<0,达到平衡后测得A气体的浓度为0.5mol·L-;当恒温下将密闭容器的容积扩大两倍并再次达到平衡时,测得A的浓度为0.3mol·L-。则下列叙述正确的是 ( )
A.平衡向右移动 B.x+y>z C.B的转化率提高 D.C的体积分数增加
15.维生素E在有“生命奇迹丸”的美称,它是一种脂溶性维生素,对抗衰老等有特殊作用,经研究发现维生素E有α、β、γ、δ四种类型,其结构简式如下:

其中R为-CH2CH2CH2[CH(CH3)CH2CH2]2CH(CH3)2。上述互为同分异构体的是( )
A.α与β B.β与γ C.γ与δ D.α与δ
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com