
题目列表(包括答案和解析)
25. (6分)由氢气和氧气反应生成1mol水蒸气放热241.8kJ,写出该反应的热化学方程式
,若1克水蒸气转化成液态水放热2.444kJ,则反应H2(g)+
(6分)由氢气和氧气反应生成1mol水蒸气放热241.8kJ,写出该反应的热化学方程式
,若1克水蒸气转化成液态水放热2.444kJ,则反应H2(g)+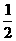 O2(g)=H2O(l)的
O2(g)=H2O(l)的 H=
KJ.mol-1,氢气的燃烧热为
H=
KJ.mol-1,氢气的燃烧热为
-----------------------KJ.mol-1
24.(11分)W、X、Y、Z四种短周期元素的原子序数X>W>Z>Y。W原子最外层电子数不超过最内层电子数。X原子L层电子数是其它各层电子总数的2倍。Y原子形成的气态氢化物分子与形成的最高价氧化物分子的电子数之比为5 :11。Z是自然界中含量最多的元素。
⑴Y和Z形成的化合物与W和Z形成的化合物反应,其化学方程式可能是:
。
(2)Y元素可形成化学式为Y60的物质,该物质称为足球烯。已知该物质溶于苯等有机溶剂,熔点较低,由此可推测Y60晶体属于 晶体,Y原子间形成 键。
(3)W、X元素的最高价氧化物对应水化物的碱性强弱为 <
(4)这四种元素原子半径的大小为 > > >
(⑶、⑷填化学式和元素符号)
23.(6分)配平氧化还原反应方程式,标出电子转移的方向和数目。
(1) NH3 + NO2 → N2 + H2O
(2)氧化产物与还原产物的质量比为 。
22.(12分)(1)向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至中性,请写出发生反应
的离子方程式:_____________________________________。
(2)在以上中性溶液中,继续滴加Ba(OH)2溶液,请写出此步反应的离子方程式:
____________________________________________________。
(3)明矾溶液与少量氢氧化钡溶液反应,请写出此步反应的离子方程式:
(4)硫酸铵与氢氧化钡溶液反应,请写出此步反应的离子方程式:
21.(6分)已知下列变化过程中,有0.2molRxO42-离子参加反应,共转移0.4mol电子。RxO42- + MnO4-+ H+ → RO2 + Mn2+ + H2O
(1)X值为____________________。
(2)参加反应的氢离子的物质的量为____________mol。
20.多硫化钠Na2Sx(X≥2)在结构上与Na2O2,FeS2等有相似之处,Na2Sx在碱性溶液中可被NaClO氧化成Na2SO4,而NaClO被还原为NaCl反应中,Na2Sx与NaClO的物质的量之比为1:16,则X值是 ( )
A、5 B、4 C、3 D、2
第Ⅱ卷(共60分)
二简答题
19.已知:I-、 Fe2+、SO2、Cl- 和H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为Cl- < Fe2+< H2O2<I-<SO2 则下列反应不能发生的是( )
A. 2Fe3+ + SO2 + 2H2O=2Fe2+ + SO42- + 4H+
B. I2 + SO2 + 2H2O=H2SO4 + 2HI
C. H2O2 +H2SO4=SO2 + O2 + 2H2O
D. 2Fe3+ + 2I-=2Fe2+ + I2
18.下列离子方程式表示错误的是( )
A、等体积等物质的量浓度的NaHCO3和Ba(OH)2两溶液混合:
HCO3-+Ba2++OH-===BaCO3↓+H2O
B、Fe2O3溶于过量氢碘酸溶液中:
Fe2O3+6H++2I-===2Fe2++3H2O
C、铜片加入稀硝酸中:
3Cu+2NO3-+8H+===3Cu2++2NO↑+4H2O
D、三氯化铁浓溶液滴入沸水中,制取氢氧化铁胶体:
Fe3++3H2O=Fe(OH)3↓+3H+
17.下列各组气体或溶液用括号内试剂加以鉴别,其中不合理的是( )
A.二氧化碳、二氧化硫、一氧化碳(品红溶液)
B.氯化钠、硝酸银、碳酸钠(稀盐酸)
C.酒精、醋酸、醋酸钠(石蕊试液)
D.硫酸、硝酸钡、氯化钾(碳酸钠溶液)
16.在一定条件下,CO和CH4燃烧的热化学方程式分别为 ( )
2CO(g)+O2(g)=2CO2(g);△H=-566KJ/mol
CH4(g)+2O2(g)=2CO2(g)+2H2O(l);△H=-890KJ/mol
由等物质的量的CO和CH4的混合气体共4mol,在上述条件下完全燃烧时释放的热量为( )
A.1173KJ B.1456KJ C.2346KJ D.1780KJ
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com